UP Board and NCERT Solution of Class 9 Science [विज्ञान] ईकाई 1 द्रव्य- प्रकृति एवं व्यवहार – Chapter-4 Structure Of The Atom (परमाणु की संरचना ) NCERT Based Important Question Answer
प्रिय पाठक! इस पोस्ट के माध्यम से हम आपको कक्षा 9वीं विज्ञान ईकाई 1 द्रव्य- प्रकृति एवं व्यवहार के अंतर्गत चैप्टर4 (परमाणु की संरचना) पाठ के NCERT के कुछ महत्वपूर्ण प्रश्न उत्तर सहित प्रदान किया जा रहे हैं । UP Board आधारित प्रश्न हैं। आशा करते हैं कि पोस्ट आपको पसंद आयेगी अगर पोस्ट आपको पसंद आई तो इसे अपने दोस्तों के साथ में जरुर शेयर करें

| Class | 9th | Subject | Science (Vigyan) |
| Pattern | NCERT | Chapter- | Structure Of The Atom |
NCERT Based Important Question Answer
प्रश्न 1. इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन के गुणों की तुलना कीजिए। उत्तर–इलेक्ट्रॉन, प्रोटॉन व न्यूटॉन के गुणों की तुलना –
| क्रम सख्या | गुण | इलेक्ट्रॉन | प्रोटॉन | न्यूट्रॉन |
| 1. | आवेश | इस पर इकाई ऋणावेश होता है जिसका मान 1.6 × 10-19 C है। | इस पर इकाई धनावेश होता है जिसका मान 1.6 × 10-19 C है। | इस पर कोई आवेश नहीं होता है। |
| 2. | संहति | एक इलेक्ट्रॉन की संहति 9.1 × 10-31 kg होती है। | प्रोटॉन की संहति हाइड्रोजन के एक परमाणु की संहति के समान होती है। | इसकी संहति. प्रोटॉन की संहति के लगभग समान होती है। |
| 3. | परमाणु में स्थिति | ये नाभिक के चारों ओर चक्कर लगाते हैं। | ये नाभिक के अन्दर स्थित होते हैं। | ये भी नाभिक के अन्दर स्थित होते हैं। |
प्रश्न 2. जे. जे. टॉमसन के परमाणु मॉडल की क्या सीमाएँ हैं?
उत्तर – टॉमसन के परमाणु मॉडल की कमियाँ – जे.जे. टॉमसन ने परमाणु को एक गोले के रूप में प्रतिपादित किया, जिसमें प्रोटॉनों की उपस्थिति के कारण धनात्मक आवेश होता है और इलेक्ट्रॉन इसके अन्दर धँसे होते हैं। टॉमसन के पास इसे प्रायोगिक रूप में सिद्ध करने का कोई प्रमाण नहीं था और इस मॉडल द्वारा दूसरे वैज्ञानिकों द्वारा किये गये प्रयोगों के परिणामों को भी नहीं समझाया जा सकता है।
प्रश्न 3.रदरफोर्ड के परमाणु मॉडल की क्या सीमाएँ हैं ?
उत्तर – रदरफोर्ड के परमाणु मॉडल की कमियाँ– रदरफोर्ड ने प्रस्तावित किया कि इलेक्ट्रॉन धनावेशित नाभिक के चारों ओर घूमते हैं (या चक्कर लगाते हैं)। अतः नाभिक व घूमने वाले इलेक्ट्रॉनों के मध्य आकर्षण बल इलेक्ट्रॉनों के अपकेन्द्रिय बल से संतुलित हो जाता है। परन्तु जब आवेशित वस्तु वृत्ताकार पथ पर घूमती है तो वह विकिरण उत्सर्जित करती है, जिससे ऊर्जा में हानि होती है। इसके फलस्वरूप इलेक्ट्रॉनों को नाभिक में गिर जाना चाहिए। अगर ऐसा होता तो परमाणु अस्थिर हो जायेगा। परन्तु परमाणु स्थायी है। इन सब तथ्यों की रदरफोर्ड व्याख्या न कर सका और परमाणु की स्थिरता के कारण की व्याख्या भी नहीं कर सका।
प्रश्न 4. बोर के परमाणु मॉडल की व्याख्या कीजिए।
उत्तर – बोर का परमाणु मॉडल – रदरफोर्ड के परमाणु मॉडल की त्रुटियों का निवारण करके बोर ने परमाणु का नया मॉडल प्रस्तावित किया। उसकी मुख्य धाराएँ निम्नलिखित हैं-
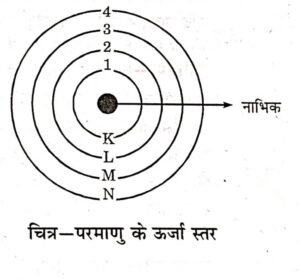
(1) इलेक्ट्रॉन परमाणु के नाभिक के चारों ओर निश्चित कक्षाओं में चक्कर लगाते हैं जिन्हें कक्ष कहते हैं।
(2) एक इलेक्ट्रॉन जब किसी कक्ष में चक्कर लगाता है तो उसमें निश्चित ऊर्जा होती है और ऊर्जा का विकिरण नहीं होता।
(3) प्रत्येक कक्ष की अपनी निश्चित ऊर्जा होती है इसीलिए उन्हें ऊर्जा स्तर कहा जाता है।
(4) इन ऊर्जा स्तरों को K, L, M, N… द्वारा या 1, 2, 3, 4 प्रदर्शित करते हैं।
प्रश्न 5. इस अध्याय में दिए सभी परमाणु मॉडलों की तुलना कीजिए।
उत्तर – इस अध्याय में टॉमसन, रदरफोर्ड व बोर के परमाणु मॉडल दिये गये हैं। इनकी तुलना निम्न प्रकार से कर सकते हैं-
| क्र. सं. | टॉमसन मॉडल | रदरफोर्ड मॉडल | बोर मॉडल |
| 1 | टॉमसन मॉडल के अनुसार धनात्मक आवेशित कण गोले के बाह्य तल पर होते हैं। | रदरफोर्ड मॉडल के अनुसार धनावेशित कण छोटे से केन्द्रीय भाग में स्थित होता है जिसे नाभिक कहते हैं। | बोर के मॉडल के आधार पर भी धनावेश केन्द्र में स्थित होता है जिसे नाभिक कहते हैं। |
| 2 | ऋणावेशित इलेक्ट्रॉन धनावेशित गोले में धँसे होते हैं। | इलेक्ट्रॉन (ऋणावेशित कण) नाभिक के चारों ओर चक्कर लगाते हैं। | इलेक्ट्रॉन नाभिक के बाहर अपने निश्चित वृत्तीय कक्षों में चक्कर लगाते हैं। |
| 3 | इस मॉडल से हमें इलेक्ट्रॉनों की ऊर्जा के विषय में ज्ञान नहीं होता। | रदरफोर्ड मॉडल में इलेक्ट्रॉनों की ऊर्जा के विषय में ज्ञान नहीं होता । | इस मॉडल के अनुसार इलेक्ट्रॉन की ऊर्जा उनके चक्कर लगाने वाले कक्षों के अनुसार निश्चित होती है। |
| 4 | इसमें इलेक्ट्रॉनों के वितरण विषय में कोई जानकारी प्राप्त नहीं होती। | इसमें भी वितरण के विषय में जानकारी प्राप्त नहीं होती। | इलेक्ट्रॉन कक्षों में निश्चित संख्या में चक्कर लगाते हैं और प्रत्येक कक्ष की ऊर्जा निश्चित होती है। |
प्रश्न 6. पहले अठारह तत्त्वों के विभिन्न कक्षों में इलेक्ट्रॉन वितरण के नियमों को लिखिए।
उत्तर– प्रथम 18 तत्त्वों के इलेक्ट्रॉनिक विन्यास लिखने के लिए प्रयोग किए गए नियम निम्न प्रकार से हैं-
(1) किसी भी कक्ष में उपस्थित इलेक्ट्रॉन की संख्या एक सूत्र 2n² द्वारा ज्ञात की जाती है, जहाँ संख्या। अतः अधिकतम कक्ष की संख्या या ऊर्जा स्तर की इलेक्ट्रॉनों की संख्या
पहले कक्ष (K) में होगी = 2 × 12 = 2
दूसरे कक्ष (L) में होगी. = 2 x 22 = 8
तीसरे कक्ष (M) में होगी = 2 x 32 = 18
चौथे कक्ष (N) में होगी = 2 x 42 = 32
(2) बाह्यतम कोश में अधिकतम आठ इलेक्ट्रॉन रखे जा सकते हैं।
(3) पहले कक्ष में इलेक्ट्रॉनों की संख्या पूर्ण होने पर शेष इलेक्ट्रॉन दूसरे कक्ष में जा सकते हैं अर्थात् कक्ष क्रमानुसार ही भरे जाते हैं।’
प्रश्न 7. सिलिकॉन व ऑक्सीजन का उदाहरण लेते हुए संयोजकता की परिभाषा दीजिए।
उत्तर– किसी तत्त्व की संयोग करने की क्षमता को उसकी संयोजकता कहते हैं। यह उस परमाणु के बाह्यतम कोश (कक्ष) में उपस्थित इलेक्ट्रॉनों की संख्या से ज्ञात की जाती है। यदि बाह्यतम कोश में इलेक्ट्रॉनों की संख्या चार या उससे कम हो तो संयोजकता = बाह्यतम कोश में उपस्थित इलेक्ट्रॉनों की संख्या ।
उदाहरण-सिलिकॉन (Si) की परमाणु संख्या 14 है। अतः इसका इलेक्ट्रॉनिक विन्यास = 2, 8, 4
सिलिकॉन की संयोजकता = 4
यदि बाह्यतम कोश में उपस्थित इलेक्ट्रॉनों की संख्या चार से अधिक हो तो संयोजकता = 8 – बाह्यतम कोश में इलेक्ट्रॉनों की संख्या
उदाहरण – ऑक्सीजन (O) की परमाणु संख्या 8 है।
इसका इलेक्ट्रॉनिक वितरण =2,6
अतः. इसकी संयोजकता = 8-6 = 2
प्रश्न 8. उदाहरण के साथ व्याख्या कीजिए–परमाणु संख्या, द्रव्यमान संख्या, समस्थानिक और समभारिक। समस्थानिकों के कोई दो उपयोग लिखिए।
उत्तर (1) परमाणु संख्या– परमाणु के नाभिक में पाए जाने वाले (धनावेशित कण) प्रोटॉनों की संख्या को परमाणु संख्या कहते हैं। इसे Z द्वारा दर्शाया जाता है। उदाहरण– (i) कार्बन की परमाणु संख्या 6 है क्योंकि इसके नाभिक में 6 प्रोटॉन पाए जाते हैं।
(ii) ऑक्सीजन की परमाणु संख्या 8 है क्योंकि ऑक्सीजन के परमाणु के नाभिक में 8 प्रोटॉन पाए जाते हैं।
(2) द्रव्यमान संख्या– परमाणु के नाभिक में पाए जाने वाले प्रोटॉन व न्यूट्रॉन की कुल संख्या को द्रव्यमान संख्या कहते हैं। द्रव्यमान संख्या = प्रोटॉन की संख्या न्यूट्रॉन की संख्या
उदाहरण– (i) ऑक्सीजन की द्रव्यमान संख्या (परमाणु द्रव्यमान) 16 है क्योंकि ऑक्सीजन के परमाणु के नाभिक में 8 प्रोटॉन व 8 न्यूट्रॉन हैं।
अतः द्रव्यमान संख्या = 8 + 8 = 16
(ii) सोडियम की द्रव्यमान संख्या 23 है क्योंकि सोडियम के नाभिक में 11 प्रोटॉन व 12 न्यूट्रॉन हैं।
अतः द्रव्यमान संख्या 11+12= 23
(3) समस्थानिक-एक ही तत्त्व के वे परमाणु जिनके परमाणु संख्या समान परन्तु द्रव्यमान संख्या भिन्न-भिन्न हों, समस्थानिक कहलाते हैं।
उदाहरण – (i) क्लोरीन के दो समस्थानिक 35 17 CI और 37 17 Cl हैं।
35 17 Cl में द्रव्यमान संख्या 35 व परमाणु संख्या 17 है।
37 17 Cl में द्रव्यमान संख्या 37 परमाणु संख्या 17 है।
(ii) कार्बन के भी दो समस्थानिक हैं-
12 6 C, 14 6 C इनमें द्रव्यमान संख्या क्रमशः 12 व 14 है, परन्तु परमाणु संख्या 6 है।
(4) समभारिक– वे तत्त्व जिनकी परमाणु द्रव्यमान संख्या समान हो परन्तु परमाणु संख्या भिन्न-भिन्न हो समभारिक तत्त्व कहलाते हैं।
उदाहरण – ऑर्गन 40 18 Ar और कैल्सियम 40 20 Ca समभारी तत्त्व हैं क्योंकि दोनों की ‘परमाणु संख्या क्रमशः 18 व 20 है परन्तु द्रव्यमान संख्या दोनों की 40 है।
समस्थानिकों के दो उपयोग–
- यूरेनियम के एक समस्थानिक का उपयोग परमाणु भट्टी में ईंधन के रूप में किया जाता है।
- कैंसर के उपचार में कोबाल्ट के एक समस्थानिक का उपयोग होता है।
- बेंघा रोग के उपचार में आयोडीन के समस्थानिक का उपयोग होता है।
प्रश्न 9. Na+ के पूरी तरह से भरे हुए K व L कोश होते हैं– व्याख्या कीजिए।
उत्तर– Na की परमाणु संख्या = 11
Na+ में उपस्थित इलेक्ट्रॉन की संख्या 11-1 = 10
Na+ का इलेक्ट्रॉनिक विन्यास = K, L
2,8
अतः Na+ में K तथा L कोश पूरी तरह भरे होते हैं।
प्रश्न 12. यदि तत्त्व का Z = 3 हो तो उस तत्त्व की संयोजकता क्या होगी ? उस तत्त्व का नाम भी लिखिए।
उत्तर-दिया है- Z = 3
इलेक्ट्रॉनिक विन्यास = 2, 1
तत्त्व की संयोजकता = 1
तत्त्व का नाम लीथियम (Li)
प्रश्न 13. दो परमाणु स्पीशीज के केन्द्रकों का संघटन नीचे दिया गया है-
| X | Y | |
| प्रोटॉन= | 6 | 6 |
| न्यूट्रॉन= | 6 | 8 |
X और Y की द्रव्यमान संख्या ज्ञात कीजिए। इन दोनों स्पीशीज में क्या सम्बन्ध है?
हल-X की द्रव्यमान संख्या = प्रोटॉन + न्यूट्रॉन
=6+6=12 u
Y की द्रव्यमान संख्या = प्रोटॉन + न्यूट्रॉन
=6+81=4 u
X और Y दोनों में प्रोटॉनों की संख्या समान है अर्थात् दोनों की परमाणु संख्या समान है। परन्तु उनकी द्रव्यमान संख्या भिन्न है। अतः दोनों एक ही तत्त्व के समस्थानिक हैं।
प्रश्न 14. निम्नलिखित कथनों में से सही पर ‘T’ और गलत पर F लिखिए-
(a) जे. जे. टॉमसन ने यह प्रस्तावित किया था कि परमाणु के केन्द्रक में केवल न्यूक्लिऑन्स होते हैं।
(b) एक इलेक्ट्रॉन और प्रोटॉन मिलकर न्यूट्रॉन का निर्माण करते हैं इसलिए यह अनावेशित होता है।
1 (c) इलेक्ट्रॉन का द्रव्यमान प्रोटॉन से लगभग 2000 गुना होता है।
(d) आयोडीन के समस्थानिक का इस्तेमाल टिंक्चर आयोडीन बनाने में होता है। इसका उपयोग दवा के रूप में होता है।
उत्तर- (a) F (b) F (c) T (d) T.
प्रश्न संख्या 15, 16, 17 और 18 में सही के सामने (√) का चिह्न और गलत के सामने (x) का चिह्न लगाइए।
प्रश्न 15. रदरफोर्ड का अल्फा कण प्रकीर्णन प्रयोग किसकी खोज के लिए उत्तरदायी था-
(a) परमाणु केन्द्रक
(c) प्रोटॉन
(b) इलेक्ट्रॉन
(d) न्यूट्रॉन
उत्तर- (a) √, (b) x, (c) x, (d) x.
प्रश्न 16. एक तत्त्व के समस्थानिक में होते हैं-
(a) समान भौतिक गुण
(b) भिन्न रासायनिक गुण
(c) न्यूट्रॉनों की अलग-अलग संख्या
(d) भिन्न परमाणु संख्या
उत्तर- (a) x, (b) x, (c) √, (d) x.
प्रश्न 17.Cl– आयन में संयोजकता इलेक्ट्रॉनों की संख्या है-
(a) 16
(b) 8
(c) 17
(d) 18
उत्तर- (a) x, (b) √, (c) x, (d) x.
प्रश्न 18 सोडियम का सही इलेक्ट्रॉनिक विन्यास निम्न में कौन-सा है?
(a) 2, 8
(c) 2, 1, 8.
(b) 8, 2, 1
(d) 2, 8, 1
उत्तर- (a) x, (b) x, (c) x, (d) v.
प्रश्न 19. केनाल किरणें क्या हैं ?
उत्तर – केनाल किरणें- जब विसर्जन नलिका में बहुत कम दाब पर छिद्र युक्त कैथोड लेकर विद्युत विसर्जन किया जाता है तो छिद्र युक्त कैथोड से एक प्रकार की किरणें निकलती हैं जिनकी दिशा कैथोड किरणों के विपरीत होती है। ये किरणें धनावेशित कणों से मिलकर बनी होती हैं जिन्हें प्रोटॉन कहा गया। इनका द्रव्यमान हाइड्रोजन के एक परमाणु के द्रव्यमान के बराबर पाया गया।
प्रश्न 20. यदि किसी परमाणु में एक इलेक्ट्रॉन तथा एक प्रोटॉन है तो इसमें कोई आवेश होगा या नहीं ?
उत्तर – यदि किसी परमाणु में एक इलेक्ट्रॉन तथा एक प्रोटॉन होगा, तो उस पर कोई आवेश नहीं होगा क्योंकि इलेक्ट्रॉन पर उपस्थित ऋण आवेश प्रोटॉन पर उपस्थित धन आवेश को उदासीन कर देगा।
प्रश्न 21. परमाणु उदासीन है, इस तथ्य को टॉमसन के मॉडल के आधार पर स्पष्ट कीजिए।
उत्तर – टॉमसन के परमाणु मॉडल के अनुसार परमाणु धन आवेशित गोले का बना होता है और इलेक्ट्रॉन उसमें धँसे होते हैं। क्योंकि धनात्मक आवेश तथा इलेक्ट्रॉन पर उपस्थित ऋणात्मक आवेश परिमाण में समान होते हैं। अतः परमाणु उदासीन होता है।
प्रश्न 22. रदरफोर्ड के परमाणु मॉडल के अनुसार, परमाणु के नाभिक में कौन-सा अवपरमाणुक कण विद्यमान है ?
उत्तर – रदरफोर्ड के परमाणु मॉडल के अनुसार, परमाणु के नाभिक में धनावेशित कण प्रोटॉन विद्यमान है।
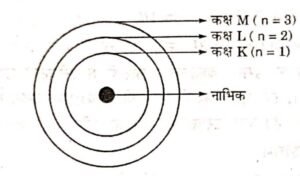
प्रश्न 23. तीन कक्षाओं वाले बोर के परमाणु मॉडल का चित्र बनाइये।
उत्तर – तीन कक्षाओं वाले बोर के परमाणु मॉडल का चित्र निम्न प्रकार से है। तीन कक्षाएँ क्रमशः K, L तथा M द्वारा दिखाई गई हैं-
प्रश्न 24. क्या अल्फा किरणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त दूसरी धातु की पन्नी से संभव होगा ?
उत्तर – अल्फा किरणों के प्रकीर्णन प्रयोग में सोने की पन्नी को इसलिए चुना गया क्योंकि सोने की परत बहुत पतली अवस्था में प्राप्त हो सकती है अर्थात् 1000 परमाणुओं की मोटाई के बराबर। यदि दूसरी भारी धातु लें तो हम इतनी पतली परत वाली पन्नी प्राप्त नहीं कर सकते अतः अल्फा किरणों का प्रकीर्णन तो इससे भी संभव होगा परन्तु परिणाम इतने स्पष्ट नहीं होंगे जितने सोने की पन्नी से प्राप्त होंगे।
प्रश्न 25. परमाणु के तीन अवपरमाणुक कणों के नाम लिखिए।
उत्तर – परमाणु के तीन अवपरमाणुक कण हैं- इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन ।
प्रश्न 26. हीलियम परमाणु का परमाणु द्रव्यमान 4u है तथा उसके नाभिक में दो प्रोटॉन होते हैं। इसमें कितने न्यूट्रान होंगे ?
उत्तर – न्यूट्रॉनों की संख्या = परमाणु द्रव्यमान – प्रोटॉन की संख्या
4-2=2 उत्तर
प्रश्न 27. अगर किसी परमाणु का K और L कोश भरा है, तो उस परमाणु में इलेक्ट्रॉनों की संख्या क्या होगी ?
उत्तर- K (पहला कक्ष)
इसमें इलेक्ट्रॉनों की संख्या = 2
L (दूसरा कक्ष)
इसमें इलेक्ट्रॉनों की संख्या = 8
अतः परमाणु में कुल इलेक्ट्रॉन = 2 + 8 = 10.
प्रश्न 28. क्लोरीन, सल्फर और मैग्नीशियम की परमाणु संख्या से आप इनकी संयोजकता कैसे प्राप्त करेंगे?
उत्तर- (i) क्लोरीन
परमाणु संख्या = 17
इलेक्ट्रॉनिक विन्यास = 2, 8, 7
क्लोरीन के बाह्यतम कोश को पूर्ण करने के लिए केवल 1 इलेक्ट्रॉन की आवश्यकता होती है। इसलिए इसकी संयोजकता 1 है।
(ii) सल्फर
परमाणु क्रमांक = 16
इलेक्ट्रॉनिक विन्यास = 2, 8, 6
क्योंकि इसके बाह्यतम कोश में 6 इलेक्ट्रॉन उपस्थित होते हैं।
अतः इसे पूर्ण रूप से भरने के लिए 2 इलेक्ट्रॉन की आवश्यकता होती है। अतः इसकी संयोजकता 2 है।
(iii) मैग्नीशियम
परमाणु क्रमांक = 12
इलेक्ट्रॉनिक विन्यास = 2, 8, 2
क्योंकि इसके बाह्यतम कोश में 2 इलेक्ट्रॉन हैं अतः इसकी संयोजकता 2 होगी।
प्रश्न 29. यदि किसी परमाणु में इलेक्ट्रॉनों की संख्या 8 है और प्रोटॉनों की संख्या भी 8 है तब,
(a) परमाणु की परमाणुक संख्या क्या है?
(b) परमाणु का क्या आवेश है?
उत्तर- (a) परमाणुक संख्या = प्रोटॉनों की संख्या = 8
प्रोटॉनों की संख्या = 8
धनात्मक आवेश = 8
इलेक्ट्रॉनों की संख्या = 8
ऋणात्मक आवेश = 8
कुल आवेश= +8+(-8) = 0
प्रश्न 30. पाठ्य-पुस्तक की सारणी 4.1 की सहायता से ऑक्सीजन और सल्फर परमाणुओं की द्रव्यमान संख्या ज्ञात कीजिए।
उत्तर- (1) ऑक्सीजन की द्रव्यमान संख्या प्रोटॉनों की संख्या न्यूट्रॉनों की संख्या= 8+8=16 u
(ii) सल्फर की परमाणु द्रव्यमान संख्या प्रोटॉनों की संख्या न्यूट्रॉनों की संख्या = 16+ 16 = 32 u