UP Board and NCERT Solution of Class 10 Science [विज्ञान] ईकाई 1 रासायनिक पदार्थ- प्रकृति एवं व्यवहार – Chapter- 1 Chemical Reactions and Equations (रासायनिक अभिक्रियाएं एवं समीकरण) दीर्घ उत्तरीय प्रश्न
प्रिय पाठक! इस पोस्ट के माध्यम से हम आपको कक्षा 10वीं विज्ञान ईकाई 1 रासायनिक पदार्थ- प्रकृति एवं व्यवहार (Chemical substances- Nature and Behavior ) के अंतर्गत चैप्टर 1 Chemical Reactions and Equations (रासायनिक अभिक्रियाएं एवं समीकरण) पाठ के दीर्घ उत्तरीय प्रश्न प्रदान कर रहे हैं। UP Board आधारित प्रश्न हैं। आशा करते हैं हमारी मेहनत की क़द्र करते हुए इसे अपने मित्रों में शेयर जरुर करेंगे।

रासायनिक अभिक्रियाएँ- रासायनिक समीकरण, संतुलित रासायनिक समीकरण, संतुलित रासायनिक समीकरण का तात्पर्य, संतुलित रासायनिक अभिक्रियाओं के प्रकार- संयोजन अभिक्रिया, अपघटन (वियोजन) अभिक्रिया, विस्थापन अभिक्रिया, द्विविस्थापन अभिक्रिया, अवक्षेपण अभिक्रिया, उदासीनीकरण, उपचयन तथा अपचयन अभिक्रिया आदि पाठ्यक्रम के टॉपिक हैं।
| Class | 10th | Subject | Science (Vigyan) |
| Pattern | NCERT | Chapter- | Chemical Reactions and Equations |
दीर्घ उत्तरीय प्रश्न
प्रश्न 1. निम्नलिखित रासायनिक अभिक्रियाओं को परिभाषित कीजिए तथा एक-एक उदाहरण भी दीजिए –
(a) संयोजन अभिक्रिया
उत्तर- संयोजन अभिक्रिया- ऐसी अभिक्रिया जिसमें दो या दों से अधिक अभिकारक मिलकर एक उत्पाद का निर्माण करते हैं, उसे संयोजन अभिक्रिया कहते हैं।
2Mg + O2→ 2MgO
(b) वियोजन अभिक्रिया
उत्तर- वियोजन या अपघटन अभिक्रिया- इसमें एकल पदार्थ वियोजित होकर दो या दो से अधिक पदार्थ बनाते हैं। वियोजन के लिए ऊष्मा, प्रकाश या विद्युत ऊर्जा की आवश्यकता होती है।
![]()
(c) विस्थापन अभिक्रिया
उत्तर- विस्थापन अभिक्रिया- ऐसी अभिक्रिया जिसमें अधिक क्रियाशील तत्त्व, कम क्रियाशील तत्त्व को उसके यौगिक से विस्थापित कर दे, विस्थापन अभिक्रिया कहलाती है।
![]()
यहाँ लेड (Pb), कॉपर (Cu) की अपेक्षा अधिक क्रियाशील तत्त्व है, जो Cu को CuCl2 से हटा देता है।
(d) द्विविस्थापन अभिक्रिया
उत्तर- द्विविस्थापन अभिक्रिया- वे अभिक्रियाएँ जिसमें अभिकारकों के बीच आयनों का आदान-प्रदान होता है, उन्हें द्विविस्थापन अभिक्रियाएँ कहते हैं।
Na2SO4(aq) + BaCl2(aq) → BaSO4($) + 2NaCl(aq)
यहाँ Ba 2+ तथा SO42- आयनों की अभिक्रिया से BaSO4 अवक्षेप का निर्माण होता है।
(e) उपचयन एवं अपचयन अभिक्रिया
उत्तर- उपचयन-अपचयन अभिक्रिया- ऑक्सीजन का योग या हाइड्रोजन का ह्रास ऑक्सीकरण या उपचयन कहलाता है जबकि ऑक्सीजन का ह्रास या हाइड्रोजन का योग अपचयन कहलाता है।
![]()
![]()
प्रश्न 2. ‘रासायनिक समीकरण’ क्या होता है? इससे क्या जानकारियाँ मिलती हैं? कोई एक उदाहरण देकर बताइए एवं इसकी कमियाँ बताइए।
उत्तर- रासायनिक समीकरण (Chemical Equation)
किसी भी रासायनिक परिवर्तन में एक या एक से अधिक पदार्थ परस्पर क्रिया करके नये पदार्थ (एक या अधिक) बनाते हैं। ऐसे परिवर्तन को गणितीय समीकरणों की भाँति एक समीकरण से व्यक्त किया जा सकता है। किसी रासायनिक परिवर्तन को व्यक्त करने वाले ऐसे समीकरण को रासायनिक समीकरण कहते हैं।
किसी रासायनिक समीकरण से निम्नलिखित जानकारी मिलती है-
(i) अभिकर्मक तत्त्वों तथा यौगिकों के नाम एवं संघटन,
(ii) उत्पादों के नाम एवं संघटन,
(iii) रासायनिक अभिक्रिया में अभिकर्मकों तथा उत्पादों का द्रव्यमानात्मक अनुपात,
(iv) अभिकर्मक गैसों तथा उत्पादित गैसों का (समान दाब तथा ताप पर) आयतनात्मक अनुपात।

(i) नाइट्रोजन गैस तथा हाइड्रोजन गैस संयोग करके अमोनिया (NH3) गैस बनाती हैं।
(ii) अमोनिया में नाइट्रोजन का 1 परमाणु तथा हाइड्रोजन के तीन परमाणु होते हैं।
(iii) रासायनिक क्रिया में द्रव्यमान के अनुसार नाइट्रोजन तथा हाइड्रोजन [2 × 14: 6×1] 14 3 के अनुपात में क्रिया करती है तथा इससे 17 भाग अमोनिया उत्पन्न होती है। [.. नाइट्रोजन का परमाणु द्रव्यमान 14 तथा हाइड्रोजन का परमाणु द्रव्यमान = 1]
(iv) दोनों अभिकर्मक तथा उत्पाद गैसे हैं। आयतन के अनुसार, इनका अनुपात, इनके अणुओं की संख्या के अनुपात में होता है। अतः समान दाब तथा ताप पर अभिक्रिया में नाइट्रोजन, हाइड्रोजन तथा अमोनिया का अनुपात 1:32 होगा-
अर्थात् 1 L नाइट्रोजन तथा 3L हाइड्रोजन के संयोग से 2L अमोनिया बनेगी।
रासायनिक समीकरण की कमियाँ (Demerits of chemical equation) – रासायनिक समीकरण से यह ज्ञात नहीं होता कि
(1) अभिकर्मकों की ली गयी तथा उत्पादों की उत्पन्न मात्राएँ क्या हैं।
(2) अभिक्रिया दाब एवं ताप की किन दशाओं में होती है।
(3) अभिक्रिया एकदिशीय (अनुत्क्रमणीय) है अथवा उत्क्रमणीय। (4) अभिक्रिया में ऊर्जा अवशोषित होती है अथवा मुक्त।
प्रश्न 3. संतुलित रासायनिक समीकरण की क्या पहचान है? किसी असंतुलित समीकरण को अनुमान विधि से संतुलित करने की क्रिया, एक सरल उदाहरण देकर समझाइए।
उत्तर- संतुलित रासायनिक समीकरण (Balanced Chemical Equation)
रासायनिक अभिक्रियाओं में न तो परमाणु नष्ट होते हैं, न नये परमाणु बनंते हैं और न ही एक तत्त्व के परमाणु से किसी दूसरे तत्त्व का परमाणु बनता है। अतः रासायनिक समीकरण में उसके दोनों पक्षों में प्रत्येक तत्त्व के परमाणुओं की मात्रा समान होनी चाहिए। तभी वह समीकरण रासायनिक क्रिया को सही रूप में व्यक्त करता है। इस प्रकार के समीकरण को संतुलित समीकरण (Balanced Equation) कहते हैं।
उदाहरणतः हाइड्रोजन तथा ऑक्सीजन गैसों के संयोग से जल बनने की क्रिया को निम्नवत् लिखा जा सकता है-
H2 + 02 → H₂O
(हाइड्रोजन) (ऑक्सीजन) (जल)
उपर्युक्त समीकरण अभिक्रिया के अभिकर्मकों तथा उत्पाद को तो व्यक्त करता है परन्तु इसमें समीकरण के दोनों पक्षों में ऑक्सीजन परमाणुओं की संख्या समान नहीं है- अर्थात् यह समीकरण संतुलित नहीं है। संतुलित करने पर इसका स्वरूप निम्नवत् हो जाता है-
2H2+O2→ 2H2O
रासायनिक समीकरण को सन्तुलित करने की अनुमान विधि (Hit and Trial Method for balanced equation)
सरल रायनिक समीकरणों को (जिनमें दो से अधिक अभिकर्मक न हों), तत्त्वों के परमाणुओं को गिनकर, संतुलित किया जा सकता है। इसे अनुमान-विधि भी कहते हैं [यद्यपि इस विधि में भी परमाणुओं की संख्या का संतुलन अनुमान में नहीं, वरन् गणितीय विधि से ही किया जाता है।]
उदाहरण 1. H2 + O2 → H2O
(i) समीकरण के बाएँ पक्ष में दो परमाणु हैं परन्तु दाहिने पक्ष में केवल एक, अतः दाहिने पक्ष में 2 अणु लेने से परमाणुओं का संतुलन हो जाता है अर्थात्
H2+O2→ 2H2O
(ii) अब दाहिने पक्ष में H के कुल 4 परमाणु हैं तथा बाएँ पक्ष में केवल 2 अतः बायीं ओर H2 में 2 का गुणा करने से H का संतुलन हो जाता है-
2H2+O2→ 2H2O
अतः यह संतुलित समीकरण है।
प्रश्न 4. (क) ‘मन्द’ तथा ‘तीव्र’ अभिक्रिया से क्या तात्पर्य है? एक-एक उदाहरण देकर बताइए।
(ख) रासायनिक अभिक्रिया की गति को मुख्यतः कौन-से कारक प्रभावित करते हैं?
उत्तर- (क) मन्द अभिक्रियाएँ (Slow Reactions)- कुछ रासायनिक अभिक्रियाओं के पूरा होने में अधिक समय लगता है जैसे लोहे की वस्तु पर ऑक्सीजन की क्रिया से जंग (Rust) लगना। किसी लोहे की वस्तु के पूरी तरह जंग में परिवर्तित होने में अनेक वर्ष लग सकते हैं। ऐसी क्रियाओं को मन्द अभिक्रियाएँ (Slow Reactions) कहते हैं।
मन्द अभिक्रियाओं में अभिकर्मकों का उत्पादों में परिवर्तन धीरे-धीरे अर्थात् अधिक समय में होता है।
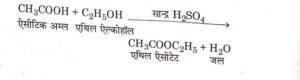
उदाहरण- सल्फ्यूरिक अम्ल (H2SO4) की उपस्थिति में एथिल ऐल्कोहॉल (C2H5OH), ऐसीटिक अम्ल (CH3COOH) से क्रिया करके एथिल ऐसीटेट (CH3COOC2H5) और जल (H₂O) बनाता है। इस अभिक्रिया को पूर्ण होने में अनेक मिनट लगते हैं। अतः यह एक मंद अभिक्रिया है।
तीव्र-अभिक्रियाएँ (Rapid Reactions)- तीव्र अभिक्रियाएँ अत्यन्त कम समय में ही पूरी हो जाती हैं। अभिकर्मकों को मिलाने पर इनके पूरे होने का समय 10-6 सेकण्ड (माइक्रो सेकण्ड) के कोटिमान का होता है।
तीव्र अभिक्रियाएँ मुख्यतः आयनों अथवा आयनिक यौगिकों के बीच होती हैं।
उदाहरण-सिल्वर नाइट्रेट (AgNO3) के विलयन को जब सोडियम क्लोराइड (NaCl) के विलयन में डालते हैं तो सिल्वर क्लोराइड (AgCl) का तत्काल सफेद अवक्षेप (Precipitate) बनता है। यह एक तात्क्षणिक (Instantaneous) अभिक्रिया है, क्योंकि आयनों के बीच होती है।
![]()
(ख) रासायनिक अभिक्रियाओं की गति को प्रभावित करने वाले प्रमुख कारक निम्नलिखित हैं-
ताप, दाब, अभिकर्मकों की मात्राएँ तथा उत्प्रेरकों की उपस्थिति अथवा अनुपस्थिति।
कुछ अभिक्रियाएँ नमी, प्रकाश आदि से भी प्रभावित होती हैं।
प्रश्न 5. विस्थापन अभिक्रिया को उदाहरण सहित समझाइए। अथवा एकल विस्थापन अभिक्रिया एवं द्विविस्थापन अभिक्रिया को उदाहरण सहित समझाइये।
उत्तर- विस्थापन अभिक्रिया– जब रासायनिक अभिक्रिया में एक तत्त्व (या पदार्थ) किसी दूसरे तत्त्व (या पदार्थ) को उसके यौगिक में से हटाकर स्वयं उसका स्थान ले लेता है तो उसे विस्थापन अभिक्रिया कहते हैं। ये दो प्रकार की होती हैं-
(i) एकल विस्थापन अभिक्रिया– किसी यौगिक में उपस्थित एक तत्त्व या (एक परमाणु) को इसके यौगिक के एक तत्त्व या (एक परमाणु) द्वारा हटाकर स्वयं उसका स्थान ले लेना एकल विस्थापन अभिक्रिया कहलाती है।
उदाहरण- कॉपर सल्फेट विलयन में जिंक धातु का टुकड़ा डालने पर जिंक द्वारा कॉपर का विस्थापन होकर जिंक सल्फेट बनता है।
![]()
(ii) द्विविस्थापन अभिक्रिया– ऐसी रासायनिक अभिक्रियाएँ जिसमें दो यौगिकों द्वारा परस्पर आयनों का विनिमय कर नये यौगिकों का निर्माण होता है तो इस क्रिया को द्विविस्थापन अभिक्रिया कहते हैं।
उदाहरण- जब सोडियम क्लोराइड के जलीय विलयन में सिल्वर नाइट्रेट विलयन मिलाते हैं तो आयनों का विनिमय होकर सिल्वर क्लोराइड और सोडियम नाइट्रेट प्राप्त होते हैं।
Na+ Cl– + Ag+ NO–3 → AgCl + NaNO3
प्रश्न 6. कारण स्पष्ट करते हुए बताइए कि निम्नांकित परिवर्तन भौतिक
हैं अथवा रासायनिक –
(i) गर्म करने पर मोम का पिघलना
उत्तर- गर्म करने पर मोम का पिघलना– भौतिक परिवर्तन है, क्योंकि इसमें मोम की केवल भौतिक अवस्था (ठोस द्रव) बदलती है-मोम की आण्विक संरचना में कोई परिवर्तन नहीं होता।
(ii) मोमबत्ती का जलना
उत्तर- मोमबत्ती का जलना- रासायनिक परिवर्तन है, क्योंकि मोम की ऑक्सीजन के साथ रासायनिक अभिक्रिया से नये पदार्थ (CO2 तथा H₂O) बनते हैं।
(iii) भोजन का पाचन
उत्तर- भोजन का पाचन– भोजन का पाचन रासायनिक परिवर्तन है, क्योंकि पाचन क्रिया में अनेक रासायनिक अभिक्रियाओं द्वारा भोजन के यौगिक, नये यौगिकों में परिवर्तित हो जाते हैं।
(iv) विद्युत् धारा प्रवाहित होने से तार का गर्म होना
उत्तर- विद्युत् धारा प्रवाहित होने से तार का गर्म होना– भौतिक परिवर्तन है, क्योंकि इससे तार की भौतिक दशा (ताप) में ही परिवर्तन होता है-तार की संरचना नहीं बदलती ।
(v) विद्युत धारा प्रवाहित होने से जल का हाइड्रोजन एवं ऑक्सीजन में विघटन
उत्तर- विद्युत् धारा प्रवाहित होने से जल का हाइड्रोजन एवं ऑक्सीजन में विघटन- यह रासायनिक परिवर्तन है क्योंकि जल से नये पदार्थ हाइड्रोजन एवं ऑक्सीजन बनते हैं।
(vi) शुष्क चूने को जल में मिलाने पर जल का गर्म हो जाना
उत्तर- शुष्क चूने को जल में मिलाने पर जल का गर्म हो जाना- यह रासायनिक परिवर्तन है, क्योंकि चूना (CaO) तथा जल (H2O) के रासायनिक संयोग से नया पदार्थ Ca(OH)2 बनता है।
(vii) शर्करा घोलने पर जल का कुछ ठण्डा हो जाना
उत्तर- शर्करा घोलने पर जल का कुछ ठण्डा हो जाना– भौतिक परिवर्तन है, क्योंकि विलयन बनने पर शर्करा एवं जल का मिश्रण बनता है, कोई नया पदार्थ नहीं।
(viii) कॉपर सल्फेट विलयन में लोहे के टुकड़े डालने पर उनके रंग का काले से लाल हो जाना।
उत्तर- कॉपर सल्फेट विलयन में लोहे के टुकड़े डालने पर उसके रंग का काले से लाल हो जाना– रासायनिक परिवर्तन है, क्योंकि कॉपर सल्फेट के विघटन से नया पदार्थ कॉपर बनता है जो लोहे के टुकड़ों पर एकत्र हो जाता है।
प्रश्न 7. कारण देते हुए निम्नांकित अभिक्रियाओं को ऊष्माक्षेपी एवं ऊष्माशोषी में वर्गीकृत कीजिए-
(i) 2NH3 → N2+3H2-24 kcal
(ii) 2SO2+O2→2SO3+25 kcal
(iii) N2+O2+45 kcal → 2NO
उत्तर- (i) 2NH3 → N2+3H2-24 kcal
उपर्युक्त अभिक्रिया को निम्नवत् लिखा जा सकता है-
2NH3+24 kcal→ N2 + 3H2
चूँकि अभिक्रिया सम्पन्न कराने हेतु NH3 को 24 kcal ऊष्मा देना आवश्यक है- अतः यह ऊष्माशोषी अभिक्रिया है।
(ii) 2SO2+O2→2SO3 +25 keal
अभिक्रिया में SO3 के साथ 25 kcal ऊष्मा भी प्राप्त होती है-अतः यह ऊष्माक्षेपी अभिक्रिया है।
(iii) N2+O2+45 keal→ 2NO
अभिक्रिया सम्पन्न होने के लिए No तथा O को 25 kcal ऊष्मा देना आवश्यक है अतः यह ऊष्माक्षेपी अभिक्रिया है।