UP Board and NCERT Solution of Class 10 Science [विज्ञान] ईकाई 1 रासायनिक पदार्थ- प्रकृति एवं व्यवहार – Chapter- 3 Metals and Non-Metals ( धातु और अधातु )
अतिलघु उत्तरीय प्रश्न एवं लघु उत्तरीय प्रश्न
प्रिय पाठक! इस पोस्ट के माध्यम से हम आपको कक्षा 10वीं विज्ञान ईकाई 1 रासायनिक पदार्थ- प्रकृति एवं व्यवहार (Chemical substances- Nature and Behavior ) के अंतर्गत चैप्टर 3 Metals and Non-Metals ( धातु और अधातु ) पाठ के अतिलघु उत्तरीय प्रश्न एवं लघु उत्तरीय प्रश्न प्रदान कर रहे हैं। UP Board आधारित प्रश्न हैं। आशा करते हैं हमारी मेहनत की क़द्र करते हुए इसे अपने मित्रों में शेयर जरुर करेंगे।

धातु, अधातु, धातुओं की प्राप्ति, धातुकर्म, धातुओं का संक्षारण, मिश्र धातु
| Class | 10th | Subject | Science (Vigyan) |
| Pattern | NCERT | Chapter- | Metals and Non Metals |
अतिलघु उत्तरीय प्रश्न / लघु उत्तरीय प्रश्न
अतिलघु उत्तरीय प्रश्न
प्रश्न 1. दो धातुओं के नाम लिखिए जो श्रेष्ठ, तन्य एवं आघातवर्ध्य धातुएँ हैं।
उत्तर- सोना, चांदी ।
प्रश्न 2. एक उद्दीप्त लैंप बल्ब के तंतुओं के निर्माण के लिए टंगस्टन धातु का ही उपयोग क्यों किया जाता है?
उत्तर- क्योंकि टंगस्टन धातु का गलनांक उच्च होता है।
प्रश्न 3. निम्न में से कौन-सी दो धातुएँ शारीरिक तापमान (37°C) पर पिघलने लगेंगी? गैलियम, मैग्नीशियम, सीजियम, ऐलुमिनियम ।
उत्तर- सीजियम, गैलियम।
प्रश्न 4. निम्न धातुओं को अभिक्रियाशीलता के घटते क्रम में लिखिए-
Na, K, Cu, Ag
उत्तर- K > Na > Cu > Ag
प्रश्न 5. सिलिकॉन की संयोजकता क्या होगी जिसकी परमाणु संख्या 14 है।
उत्तर- संयोजकता = 4
प्रश्न 6. सोल्डर नामक मिश्रधातु में कौन-कौन से अवयव हैं?
उत्तर- Pb और Sn
प्रश्न 7. एक ऐसी धातु का उदाहरण एक में पायी जाती है? दें जो प्रकृति में स्वतन्त्र अवस्था
उत्तर- सोना (Gold)।
प्रश्न 8. एक ऐसी अधातु का नाम लिखिए जो गैसीय अवस्था में पायी जाती है?
उत्तर- ऑक्सीजन ।
प्रश्न 9. वायुयान निर्माण में प्रयुक्त धातु का नाम लिखिए।
उत्तर- ड्यूरेलूमिन (Duralumin)
प्रश्न 10. किन अम्लों के मिश्रण को प्लेटिनम (Pt) धातु को गलाने के लिए प्रयुक्त करते हैं?
उत्तर- उत्कृष्ट धातु प्लेटिनम (Pt) को गलाने के लिए अम्लराज का प्रयोग करते हैं, जोकि सान्द्र हाइड्रोक्लोरिक अम्ल (HCl) तथा सान्द्र नाइट्रिक अम्ल (HNO) का (3:1) के अनुपात का मिश्रण है। 1
प्रश्न 11. ऐसी कौन-सी धातुएँ हैं, जिन पर सरलता से जंग नहीं लगता है? कारण सहित लिखिए।
उत्तर- गोल्ड (Au), प्लेटिनम (Pt), क्रोमियम (Cr) ऐसी धातुएँ हैं, जिन पर सरलता से जंग नहीं लगता, क्योंकि इन धातुओं की क्रियाशीलता अत्यधिक कम होती है।
प्रश्न 12. रासायनिक दृष्टिकोण से धातु तथा अधातु में मुख्य अन्तर क्या है? हाइड्रोजन में धनायन बनाने की प्रवृत्ति होती है तथापि यह अधातु है क्यों? स्पष्ट कीजिए। (UP 2014)
उत्तर- रासायनिक दृष्टिकोण से धातुओं में इलेक्ट्रॉन त्यागने की प्रवृत्ति होती है अर्थात् ये घनायन बनाने की प्रवृत्ति रखते हैं, जबकि अधातुओं में ऋणायन बनाने की प्रवृत्ति पाई जाती है। अत्यधिक छोटे आकार के कारण हाइड्रोजन में धनायन बनाने की प्रवृत्ति के साथ-साथ इलेक्ट्रॉन ग्रहण करके स्थायी ऋणायन बनाने की प्रवृत्ति भी होती है। साथ ही यह धातुओं के अन्य सामान्य लक्षण जैसे-आघातवर्धनीयता, धात्विक चमक, आदि भी नहीं दर्शाती है, अतः यह एक अधातु है।
प्रश्न 13. मिश्र-धातु क्या है? कॉपर की एक महत्त्वपूर्ण मिश्र-धातु का नाम, संघटन व उपयोग बताइए।
उत्तर- मिश्र-धातु दो या दो से अधिक धातुओं को गलित अवस्था में मिश्रित करने पर निर्मित समांगी मिश्रण को मिश्र धातु कहते हैं। गनमेटल कॉपर की एक महत्त्वपूर्ण मिश्र धातु है जिसमें Cu = 88%, Sn = 10%, Zn = 2% होते हैं। इसका उपयोग बन्दूकें, हथियार, मशीनों के पुर्जे बनाने में होता है।
प्रश्न 14. खनिज की परिभाषा दीजिए।
उत्तर- धातुओं के यौगिक पृथ्वी के अन्दर खानों में जिस रूप में पाये जाते हैं, खनिज कहलाते हैं।
प्रश्न 15. कॉपर के मुख्य अयस्कों के नाम एवं सूत्र लिखिए।
उत्तर- कॉपर के मुख्य अयस्क कॉपर के मुख्य अयस्क निम्नलिखित हैं
(i) कॉपर पाइराइट (CuFeS2)
(ii) क्यूप्राइट (Cu2O)
(iii) कॉपर ग्लान्स (Cu₂S)
(iv) मैलेकाइट [Cu(OH)2. CuCO3]
प्रश्न 16. खनिज और अयस्क में अन्तर बताइए।
उत्तर- सभी खनिज अयस्क नहीं हो सकते जबकि सभी अयस्क खनिज होते हैं।
प्रश्न 17. अयस्क क्या होते हैं?
उत्तर- वह खनिज जिसमें धातु का निष्कर्षण लाभप्रद एवं आर्थिक दृष्टि से उपयोगी होता है, अयस्क कहलाता है।
प्रश्न 18. मैट किसे कहते हैं?
उत्तर- गलित कॉपर में थोड़ी मात्रा में क्यूप्रस सल्फाइड और फेरस सल्फाइड उपस्थित होता है। इसके मिश्रण को मैट कहते हैं।
प्रश्न 19. लोहे पर Mg, Cu तथा Ag में से किस धातु की परत चढ़ाई जा सकती है और क्यों?
उत्तर- Fe की ऑक्सीकृत होने की प्रवृत्ति Cu तथा Ag से अधिक प्रबल है अतः लोहे पर Cu तथा Ag की परत चढ़ाई जा सकती है।
प्रश्न 20. विद्युत-रासायनिक श्रेणी के आधार पर स्पष्ट कीजिए कि कॉपर तनु सल्फ्यूरिक अम्ल से क्रिया करके हाइड्रोजन गैस मुक्त नहीं करती है?
उत्तर- कॉपर, विद्युत-रासायनिक श्रेणी में हाइड्रोजन से नीचे स्थित है अतः कॉपर हाइड्रोजन से कम क्रियाशील धातु है। इसलिए कॉपर तनु H2SO4 से क्रिया करके हाइड्रोजन गैस मुक्त नहीं करती है।
प्रश्न 21. सल्फ्यूरिक अम्ल में जिंक डालने पर हाइड्रोजन गैस मुक्त होती है परन्तु सिल्वर डालने पर नहीं होती है। कारण बताइए। उपर्युक्त अभिक्रिया को समीकरण द्वारा व्यक्त कीजिए।
उत्तर- जिंक विद्युत-रासायनिक श्रेणी में हाइड्रोजन से ऊपर होने के कारण अधिक सक्रिय धातु है इसलिए सल्फ्यूरिक अम्ल में जिंक डालने पर हाइड्रोजन गैस मुक्त होती है, परन्तु सिल्वर विद्युत रासायनिक श्रेणी में हाइड्रोजन से नीचे स्थित है इसलिए सिल्वर हाइड्रोजन से कम क्रियाशील है जिससे हाइड्रोजन गैस मुक्त नहीं होती है।
Zn + H2SO4 → ZnSO4 + H4
Ag + H₂SO4 → कोई अभिक्रिया नहीं
प्रश्न 22. कारण सहित समझाइए कि क्यों कॉपर सल्फेट के जलीय विलयन में लोहे की छड़ डालने पर विलयन का नीला रंग धीरे-धीरे गायब हो जाता है।
उत्तर- विद्युत-रासायनिक श्रेणी में लोहा कॉपर से ऊपर स्थित है अतः लोही कॉपर से अधिक सक्रिय धातु है। इसलिए लोहा कॉपर सल्फेट से कॉपर को विस्थापित कर देता है।
CuSO4 + Fe → FeSO4 + Cu या
Cu2+ + Fe → Fe2+ + Cu
नीले क्यूब्रिक आयन (Cu”) के Cu में बदलने के कारण विलयन का नीला रंग धीरे-धीरे गायब हो जाता है।
प्रश्न 23. फफोलेदार कॉपर क्या है?
उत्तर- 98% शुद्ध कॉपर जिसमें 2% लोहा, निकल, कोबाल्ट, लेड, सल्फर आदि की अशुद्धियों होती हैं, ‘फफोलेदार कॉपर’ कहलाता है।
प्रश्न 24. पीतल का संघटन क्या है?
उत्तर – 70% Cu + 30% Zn
प्रश्न 25. (क) निस्तापन और भर्जन में क्या अन्तर है?
(ख) गालक और धातुमल में क्या अन्तर है?
उत्तर- (क) भर्जन निस्तापन की अपेक्षा कुछ अधिक ताप तथा वायु की नियन्त्रित मात्रा की उपस्थिति में पूर्ण होता है।
(ख) गालक उच्चताप पर अशुद्धियों से क्रिया करके उन्हें विलग होने वाले पदार्थों के रूप में दूर कर देते हैं। सरलता से गलकर अलग होने वाले पदार्थ धातुमल कहलाते हैं।
प्रश्न 26. खनिज तथा अयस्क की परिभाषा एवं उदाहरण लिखिए।
उत्तर- खनिज (Minerals) प्रकृति में पृथ्वी के अन्दर धातुएँ तथा उनके यौगिक जिस रूप में पाए जाते हैं उनको खनिज कहते हैं। उदाहरणार्थ : कॉपर पायराइट (CuFeS)। अयस्क (Ores): खनिज जिसमें धातु को आसानी से कम व्यय में निष्कर्षित किया जाता है अयस्क कहलाते हैं। जैसे-बॉक्साइट, कॉपर पायराइट।
प्रश्न 27. जिंक सल्फाइड से जिंक धातु प्राप्त करने का रासायनिक समीकरण लिखिए।
उत्तर-![]()
प्रश्न 28. जिंक धातु के कार्बोनेट अयस्क से धातु निष्कर्षण का रासायनिक समीकरण देते हुए वर्णन कीजिए।
उत्तर- सर्वप्रथम जिंक कार्बोनेट को वायु की अनुपस्थिति में तीव्रता से निस्तापित करके जिंक ऑक्साइड प्राप्त करते हैं।

जिंक ऑक्साइड के कार्बन की उपस्थिति में अपचयन से जिंक धातु प्राप्त होती है।
![]()
प्रश्न 29. आयनिक यौगिकों का गलनांक उच्च क्यों होता है?
उत्तर- आयनिक यौगिकों के गलनांक उच्च होते हैं क्योंकि आयनिक यौगिकों में विपरीत आवेशित आयन प्रबल स्थिर वैद्युत आकर्षण बलों द्वारा जुड़े होते हैं। अतः इनसे बाहर आने के लिए अत्यधिक ऊष्मा की आवश्यकता होती है।
लघु उत्तरीय प्रश्न
प्रश्न 1. अधिकांश धातुएँ क्षारकों से अभिक्रिया नहीं करती हैं, पर जिंक क्षारकों से अभिक्रिया करती हैं। इसका एक कारण लिखिए।
उत्तर- जिक क्षारकों से अभिक्रिया इसलिए करती हैं क्योंकि यह एक उभयधर्मी प्रकृति का तत्त्व हैं।
Zn + 2NaOH→ Na2 ZnO2 + H2
प्रश्न 2. शुद्ध सोना 24 कैरेट का होता है, परन्तु आभूषण बनाने के लिए इसमें प्रायः 2 भाग ताँबा या चाँदी क्यों मिलाया जाता है?
उत्तर- क्योंकि 24 कैरेट का सोना काफी नर्म होता है इसलिए आभूषण बनाने के लिए यह उपयुक्त नहीं होता है। इसे कठोर बनाने के लिए इसमें 2 भाग Cu या Ag मिलाया जाता है। इसलिए भारत में ज्यादातर 22 कैरेट सोने का उपयोग आभूषण बनाने में होता है।
प्रश्न 3. क्या होता है जब लोहे की कील को कॉपर सल्फेट के विलयन में डुबोकर रखा जाता है?
उत्तर- कॉपर सल्फेट का नीला रंग हल्का हो जाता है, क्योंकि कॉपर धातु को आयरन (Fe) विस्थापित कर FeSO4 बनाता है। लोहे की कील पर लाल भूरे रंग की कॉपर की परत दिखाई देती है।
CuSO4 (aq) + Fe(s)→ FeSO4 (aq) + Cu(s)
प्रश्न 4. सिनाबार से मर्करी प्राप्त करने का रासायनिक समीकरण लिखिए।
उत्तर- सिनाबार मर्करी का एक अयस्क है।
![]()
प्रश्न 5. धातु तथा अधातु तत्त्वों के किन्हीं चार सामान्य गुणों का उल्लेख कीजिए।
अथवा धातु तथा अधातु में भौतिक गुणों के आधार पर अन्तर स्पष्ट कीजिए।
उत्तर- धातु और अधातु के गुणों में अन्तर
|
गुण |
धातु |
अधातु |
| 1. भौतिक अवस्था
2. पारदर्शिता (transparency)
3. विद्युत एवं ऊष्मा चालकता
4. तन्यता (ductility)
5. आघातवर्धनीयता (malleability)
6. भंगुरता (brittleness)
7. धात्विक चमक (metallic lustre)
8. धात्विक ध्वनि 9. धन-विद्युतीय तथा ऋण-विद्युतीय गुण
10. वैद्युत-अपघटन
11. ऑक्साइडों की प्रकृति |
अधिकांश धातुएं ठोस अवस्था में पायी जाती हैं। केवल सीजियम, फ्रेन्शियम, गैलियम तथा मरकरी द्रव हैं
सामान्यतः धातुएँ अपा रदर्शी (opaque) होती हैं। सभी धातुएँ विद्युत एवं ऊष्मा की सुचालक होती हैं। धातुएँ तन्य (ductile) होती हैं अर्थात् उनके चार खींचे जा सकते हैं। धातुएँ आघातवर्धनीय होती हैं अर्थात् हथौड़े से पीटने पर उनके पृष्ठ (surface) के क्षेत्रफल में वृद्धि होती है। धातुएँ भंगुर (brittle) नहीं होती हैं। धातुओं में एक विशेष प्रकार की चमक पायी जाती हैं जिसे धात्त्विक चमक कहते हैं।
धातुओं के आपस में टकराने पर विशेष ध्वनि प्राप्त होती है। धातुएँ धनायन बनाने की प्रवृत्ति रखती हैं तथा धन-विद्युतीय तत्त्व कहलाती हैं। वैद्युत-अपघटन के फल- स्वरूप धातुएँ ऋणोद (cathode) पर प्राप्त होती हैं। धातुओं के ऑक्साइड क्षारीय होते हैं अर्थात् जल के साथ क्षार बनाते हैं तथा लाल लिटमस को नीला कर देते हैं। |
अधातुएं द्रव्य की तीनों अवस्थाओं अर्थात् ठोस, द्रव तथा गैस के रूप में पायी जाती हैं।
अधातुएँ, पारदर्शी, अपार- दर्शी या पारभासक होती हैं। ग्रेफाइट को छोड़कर लगभग सभी अधातुएँ विद्युत तथा ऊष्मा की कुचालक होती हैं। अधातुएँ तन्य नहीं होती है। अधातुएँ आधातवर्धनीय नहीं होती है।
अधातुएँ भंगुर होती हैं अर्थात् हथौड़े से पीटने पर वे छोटे-छोटे कणों में टूट जाती हैं। ग्रेफाइट तथा आयोडीन को छोड़कर लगभग सभी अधातुओं में कोई विशेष चमक नहीं पायी जाती हैं। अधातुओं के आपस में टकराने पर विशेष ध्वनि प्राप्त नहीं होती है। अधातुएँ ऋणायन बनाने की प्रवृत्ति रखती हैं तथा ऋण-विद्युतीय तत्त्व कहलाती हैं। वैद्युत-अपघटन के फल- स्वरूप अधातुएँ धनोद (anode) पर प्राप्त होती हैं। अधातुओं के ऑक्साइड अम्लीय होते हैं अर्थात् जल के साथ अम्ल बनाते हैं तथा नीले लिटमस को लाल कर देते हैं। |
प्रश्न 6. विद्युत-रासायनिक श्रेणी क्या है? समझाइए कारण सहित स्पष्ट कीजिए कि निम्नलिखित रासायनिक अभिक्रिया सम्भव है या नहीं-
Hg + H₂SO₄ → HgSO₄ + H₂
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
अथवा विद्युत-रासायनिक श्रेणी की सहायता से धातुओं द्वारा अम्लों से विस्थापित करने की क्षमता किस प्रकार ज्ञात करते हैं। उदाहरण सहित स्पष्ट कीजिए।
उत्तर- विद्युत-रासायनिक श्रेणी- जब धातुओं को उनके मानक इलेक्ट्रोड विभव के बढ़ते हुए क्रम में रखा जाता है तो एक श्रेणी प्राप्त होती है जिसे धातुओं की ‘विद्युत-रासायनिक श्रेणी’ कहते हैं। हाइड्रोजन को श्रेणी के मध्य में रखा गया है और इसका मानक इलेक्ट्रोड विभव शून्य माना गया है।
Hg+H₂SO₄ → HgSO₄ + H₂
विद्युत-रासायनिक श्रेणी में Hg, हाइड्रोजन से नीचे स्थित है अतः Hg, हाइड्रोजन से कम सक्रिय धातु है। इसलिए Hg, H₂SO₄ से H₁ को विस्थापित नहीं कर सकती अर्थात् यह क्रिया सम्भव नहीं है।
Cu+2AgNO3→ Cu(NO₃)₂ + 2Ag
विद्युत-रासायनिक श्रेणी में कॉपर (Cu), सिल्वर (Ag) से ऊपर स्थित है अतः कॉपर, सिल्वर से अधिक सक्रिय धातु है। इसलिए Cu. AgNO3 से सिल्वर को विस्थापित कर देगी अर्थात् यह क्रिया सम्भव है।
प्रश्न 7. मानक हाइड्रोजन इलेक्ट्रोड का स्पष्ट नामांकित चित्र बनाइए एवं वर्णन कीजिए।
उत्तर- मानक हाइड्रोजन इलेक्ट्रोड (SHE) बनाने के लिए 1 मोलर हाइड्रोजन आयन सान्द्रता (1M [H]) के जलीय विलयन में एक प्लैटिनम की प्लेट, जिस पर प्लैटिनम ब्लैक की परत जमी होती है, लटका देते हैं। 25°C और 1 वायुमण्डल दाव पर हाइड्रोजन गैस विलयन में प्रवाहित करते हैं। गैस की कुछ मात्रा प्लैटिनम ब्लैक द्वारा अवशोषित हो जाती है।

प्रश्न 8. भर्जन क्या है? यह क्रिया किन सान्द्रित अयस्कों के लिए प्रयोग में लायी जाती है? इस क्रिया में प्रयुक्त होने वाली भट्टी का नामांकित चित्र वनाइए।
अथवा भर्जन क्रिया को उदाहरण द्वारा समझाइए। यह निस्तापन से किस प्रकार भिन्न है?
अथवा कॉपर पाइराइट के भर्जन में होने वाली अभिक्रियाओं के रासायनिक समीकरण लिखिए।
अथवा परावर्तनी भट्टी का सचित्र वर्णन कीजिए। कॉपर के निष्कर्षण में इसमें होने वाले रासायनिक समीकरण लिखिए।
अथवा भर्जन तथा निस्तापन अभिक्रिया को समझाइए।
अथवा निस्तापन क्रिया को उदाहरण द्वारा परिभाषित कीजिए।
अथवा भर्जन से आप क्या समझते हैं? उदाहरण सहित समझाइए।
उत्तर- भर्जन- सान्द्रित अयस्क को परावर्तनी भट्टी में उसके गलनांक के नीचे नियन्त्रित वायु की उपस्थिति में इतना गर्म किया जाता है कि यह बिना पिघले ऑक्सीकृत हो जाये। परावर्तनी
भट्टी में निम्नलिखित अभिक्रियाएँ होती है-
अयस्क में उपस्थित सल्फर, आर्सेनिक, ऐन्टिमनी की अशुद्धियाँ ऑक्सीकृत होकर अपने वाष्पशील ऑक्साइड के रूप में बाहर निकल जाती हैं।
S + O2 → SO2↑
4As + 302 → 2As2 03
4Sb + 302 → 2Sb₂O3
कॉपर पाइराइट का क्यूप्रस सल्फाइड (Cu2S) व फेरस सल्फाइड में आंशिक ऑक्सीकरण हो जाता है।
2CuFeS2 +02 → Cu2S+ 2FeS + SO2↑
क्यूप्रस सल्फाइड तथा फेरस सल्फाइड भी आंशिक रूप से क्रमशः Cu₂O तथा FeO में ऑक्सीकृत हो जाते हैं।
2Cu₂S + 302 → 2Cu₂ O + 2SO2
2FeS +302→ 2FeO + 2SO2
भर्जन क्रिया सल्फाइड सान्द्रित अयस्कों के लिए प्रयोग में लायी जाती है।. इस क्रिया में परावर्तनी भट्टी का प्रयोग किया जाता है।
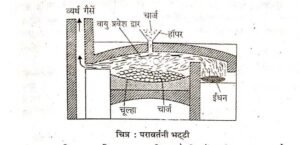
निस्तापन- निस्तापन वह क्रिया है जिसमें सान्द्रित अयस्क को इतना गर्म किया जाता है कि वह पिघले नहीं। इस क्रिया में अयस्क में से जल व वाष्पशील पदार्थ निकल जाते हैं और अयस्क सरन्ध्र (Porous) हो जाता है। यह विधि कार्बोनेट व जलीय ऑक्साइड अयस्कों के साथ प्रयुक्त होती है।
ZnCO3 (कैलेमाइन) →ZnO + CO2
2Fe2 03.3H2O → 2Fe2O3+3H2O
प्रश्न 9. इलेक्ट्रोड विभव किसे कहते हैं? यह किन-किन कारकों पर निर्भर करता है?
उत्तर- इलेक्ट्रोड विभव (Electrode Potential)- जब किसी धातु की छड़ को उसी धातु के लवण के विलयन में डुबोया जाता है तो धातु की छड़, विलयन के सापेक्ष धनावेशित अथवा ऋणावेशित हो जाती है। इसके फलस्वरूप धात् और विलयन के स्पर्श तल पर एक विभवान्तर स्थापित हो जाता है जिसे धातु का इलेक्ट्रोड विभव कहते हैं। इलेक्ट्रोड विभव (E) धातु की प्रकृति, विलयन में उपस्थित उस धातु के आयनों की सान्द्रता तथा ताप पर निर्भर करता है।
प्रश्न 10. विद्युत-रासायनिक श्रेणी के आधार पर स्पष्ट कीजिए कि निम्नलिखित अभिक्रियाएँ सम्भव हैं या नहीं-
- Zn + H₂SO₄→ ZnSO4 + H₂↑
- Cu+H₂SO₄→ CuSO₄ + H2↑
उत्तर- (i) विद्युत-रासायनिक श्रेणी में जिंक हाइड्रोजन से ऊपर स्थित है अतः जिंक (Zn) हाइड्रोजन से अधिक सक्रिय है। इसलिए जिक H₂SO₄ से H2 को विस्थापित्त कर देगा, अर्थात्
Zn + H₂SO₄→ ZnSO4 + H₂, अभिक्रिया सम्भव है।
(ii) विद्युत-रासायनिक श्रेणी में कॉपर हाइड्रोजन से नीचे स्थित है अतः Cu हाइड्रोजन से कम सक्रिय धातु है। इसलिए कॉपर H2SO2 से हाइड्रोजन विस्थापित नहीं कर सकता है, अर्थात्
Cu + H₂SO₄ → CuSO + H₂, अभिक्रिया सम्भव नहीं है।
प्रश्न 11. सिल्वर नाइट्रेट के विलयन में कॉपर डालने से विलयन का रंग नीला हो जाता है, क्यों?
अथवा क्या होता है जब कॉपर की छड़ को सिल्वर नाइट्रेट के विलयन में डालते हैं?
उत्तर- कॉपर धातु, सिल्वर नाइट्रेट विलयन से सिल्वर को विस्थापित कर देती है क्योंकि विद्युत रासायनिक श्रेणी में कॉपर का स्थान सिल्वर से ऊपर है, अर्थात् कॉपर की ऑक्सीकरण प्रवृत्ति (इलेक्ट्रॉन त्यागने की प्रवृत्ति) सिल्वर से अधिक है।
2AgNO3 + Cu → Cu(NO₃)₂ + 2Ag
या
2Ag+ +Cu → Cu²+ + 2Ag
क्यूप्रिक आयन Cu++ बनने के कारण विलयन नीला हो जाता है।
प्रश्न 12. इलेक्ट्रोड विभव क्या है? इसे कैसे मापा जाता है? एक उदाहरण द्वारा स्पष्ट कीजिए।
उत्तर- इलेक्ट्रोड विभव- [लघु उत्तरीय प्रश्न 11 के अन्तर्गत देखिए। इलेक्ट्रोड विभव का निर्धारण मानक हाइड्रोजन इलेक्ट्रोड या सामान्य हाइड्रोजन इलेक्ट्रोड का प्रयोग करके किया जाता है, जिसका इलेक्ट्रोड विभव शून्य होता है। जिस धातु इलेक्ट्रोड का मानक इलेक्ट्रोड विभव मापा, जाना होता है, उसे सान्द्रता और ताप की मानक परिस्थितियों में पोटैशियम क्लोराइड साल्ट ब्रिज द्वारा मानक हाइड्रोजन इलेक्ट्रोड से जोड़ देते हैं और प्राप्त गैल्वैनी सेल का विद्युत वाहक बल वोल्टमीटर से माप लेते हैं। इस सेल का जो विद्युत वाहक बल होता है, उसे ही धातु का मानक इलेक्ट्रोड विभव कहते हैं। प्रश्न 13. अयस्कों का सान्द्रण करना क्यों आवश्यक है?
उत्तर- पृथ्वी के अन्दर खानों से प्राप्त अयस्क में मिट्टी के कण, धूल, बालू तथा पत्थर के छोटे-छोटे टुकड़े आदि अशुद्धियों के रूप में उपस्थित होते हैं जिन्हें दूर करने के लिए अयस्कों का सान्द्रण करना आवश्यक है।
प्रश्न 14. मिश्रधातुएँ क्या हैं? कॉपर के किन्हीं चार मिश्रधातुओं के नाम तथा उनका संघटन बताइए एवं मुख्य उपयोग लिखिए।
अथवा पीतल, काँसा तथा गन मेटल में कॉपर की प्रतिशत मात्रा लिखिए।
अथवा मिश्रधातु से आप क्या समझते हैं?
उत्तर- मिश्रधातुएँ- “दो या दो से अधिक धातुओं अर्थवा एक धातु व एक अधातु के समांग मिश्रण को मिश्रधातु (Alloys) कहते हैं।”
कॉपर की मिश्रधातुएँ तथा उनका संघटन एवं उपयोग-
|
विश्रधान का नाम |
संघटन |
उपयोग |
|
| 1. | पीतल | 70% Cu, 30% Zn | बर्तन तथा तार बनाने में।
|
| 2. | गन मेटल | 88% Cu 10% Sn, 2% Zn
|
बन्दूक तथा मशीनों के पुर्जे बनाने में। |
| 3. | कृत्रिम गोल्ड (रोल्ड गोल्ड) | 95% Cu, 5% Al
|
आभूषण बनाने में। |
| 4. | काँसा | 88% Cu. 12% Sn | वर्तन तथा मूर्तियों बनाने में। |
प्रश्न 15. धातु एवं उसके मिश्रधातु के गुणों में प्रमुख भिन्नता क्या हैं?
उत्तर- धातु तथा उसके मिश्रधातु के गुणों में भिन्नता-
(i) मिश्रधातुओं के गलनांक उनके शुद्ध घटक धातुओं के गलनांक से कम होते हैं।
(ii) मिश्रधातुओं की कठोरता और भंगुरता (Brittleness) घटक धातुओं से अधिक होती है।
(iii) मिश्रधातुओं की विद्युत चालकता घटक धातुओं से कम होती है।
प्रश्न 16. धातुमल तथा गालक से क्या तात्पर्य है? एक उदाहरण लिखिए।
अथवा गालक से आप क्या समझते हैं? किसी एक अम्लीय गालक की क्रिया को केवल रासायनिक समीकरण द्वारा स्पष्ट कीजिए।
उत्तर- गालक वे पदार्थ हैं जो अयस्क में उपस्थित अगलनीय (Infusible) अशुद्धियों से उच्च ताप पर क्रिया करके एक गलनीय यौगिक बना लेते हैं। इन गलनीय यौगिकों को धातुमल (Slag) कहते हैं, यह धातु से हल्का होने के कारण उस पर तैरता रहता है, जिसे बाद में दूर कर देते हैं।
गालक दो प्रकार के होते हैं-
- अम्लीय गालक (Acidic Flux)- ये क्षारीय अशुद्धियों को दूर करने के लिए प्रयुक्त किये जाते हैं, जैसे-SiO2 (सिलिका)।

- क्षारीय गालक (Basic Flux)- ये अम्लीय अशुद्धियों को दूर करने के लिए प्रयुक्त किये जाते हैं, जैसे-CaO (डोलोमाइट), MgO (मैग्नीशिया)।

प्रश्न 17. सल्फर डाइऑक्साइड गैस की विरंजन क्रिया समझाइए
तथा ऑक्सीकारक व अपचायक गुणों का समीकरण लिखिए।
अथवा सल्फर डाइऑक्साइड की विरंजक क्रिया क्यों अस्थायी है?
उत्तर- SO, की विरंजन क्रिया अपचयन द्वारा होती है। अतः SO, द्वारा विरंजित वस्तु को जब वायु में रखते हैं तब यह वायु की ऑक्सीजन से ऑक्सीकृत हो जाती है और पुनः रंगीन हो जाती है।
SO2+2H₂O → H₂SO₄ + 2[H]
रंगीन पदार्थ + [H] → रंगहीन अपचयित पदार्थ
रंगहीन पदार्थ + O2 (वायु में) → रंगीन पदार्थ
अतः SO2 की विरंजक क्रिया अस्थायी है।
उपचायक के रूप में-
2FeCl3 + 2H2O+SO2→ 2FeCl2 + H2SO4 +2HCI
ऑक्सीकारक के रूप में मैं-PbO2 + SO2 →PbSO4
प्रश्न 18. प्रगलन क्या है? उदाहरण सहित समझाइए।
उत्तर- प्रगलन- अयस्क में उचित मालक तथा कोक मिलाकर मिश्रण को उच्च ताप पर गलाने की क्रिया को प्रगलन कहते हैं। इस क्रिया में गालक अशुद्धियों से मिलकर कम गलनांक का धातुगल बनाते हैं जो हल्का होने के कारण पिघली धातु की सतह पर आ जाता है जिसे आसानी से पृथक किया जा सकता है।
उदाहरण- लोहे के धातुकर्म में सिलिका (SiO₂) अपद्रव्य के रूप में उपस्थित होते हैं। इसमें गालक CaO मिलाकर प्रगलन करने पर कैल्सियम सिलिकेट नामक धातुमल बनता है।
![]()