UP Board and NCERT Solution of Class 9 Science [विज्ञान] ईकाई 1 द्रव्य- प्रकृति एवं व्यवहार – Chapter-3 Atoms and Molecules ( परमाणु एवं अणु ) NCERT Based Important Question Answer
प्रिय पाठक! इस पोस्ट के माध्यम से हम आपको कक्षा 9वीं विज्ञान ईकाई 1 द्रव्य- प्रकृति एवं व्यवहार के अंतर्गत चैप्टर3 (परमाणु एवं अणु) पाठ के NCERT के कुछ महत्वपूर्ण प्रश्न उत्तर सहित प्रदान किया जा रहे हैं । UP Board आधारित प्रश्न हैं। आशा करते हैं कि पोस्ट आपको पसंद आयेगी अगर पोस्ट आपको पसंद आई तो इसे अपने दोस्तों के साथ में जरुर शेयर करें

| Class | 9th | Subject | Science (Vigyan) |
| Pattern | NCERT | Chapter- | Atoms and Molecules |
NCERT Based Important Question Answer
प्रश्न 1. एक अभिक्रिया में 5.3 g सोडियम कार्बोनेट एवं 6.0 g ऐसीटिक अम्ल अभिकृत होते हैं। 2.2 g कार्बन डाइऑक्साइड, 8.2 g सोडियम ऐसीटेट तथा 0.9 g जल उत्पाद के रूप में प्राप्त होते हैं। इस अभिक्रिया द्वारा दिखाइए कि यह परीक्षण द्रव्यमान संरक्षण के नियम के अनुरूप है।
सोडियम कार्बोनेट + ऐसीटिक अम्ल → सोडियम ऐसीटेट + कार्बन डाइऑक्साइड + जल
उत्तर – दी गई रासायनिक अभिक्रिया निम्न प्रकार से है-
सोडियम कार्बोनेट + ऐसीटिक अम्ल→सोडियम ऐसीटेट + कार्बन डाइऑक्साइड + जल
(i) अभिकर्मकों की कुल द्रव्यमान = सोडियम कार्बोनेट का द्रव्यमान + ऐसीटिक अम्ल का द्रव्यमान
= 5.3 g + 6.0 g = 11.3 g
(ii) उत्पादों का कुल द्रव्यमान= सोडियम ऐसीटेट + कार्बन डाइऑक्साइड + जल का द्रव्यमान
=8.2 g +2.2 g +0.9 g 11.3 g
अभिकर्मकों की कुल द्रव्यमान तथा उत्पादों का कुल द्रव्यमान समान है। अतः ये द्रव्यमान संरक्षण के नियम को प्रदर्शित करते हैं।
प्रश्न 2. हाइड्रोजन एवं ऑक्सीजन द्रव्यमान के अनुसार 1:8 के अनुपात में संयोग करके जल बनाते हैं। 3g हाइड्रोजन गैस के साथ पूर्णतया संयोग करने के लिए कितने ऑक्सीजन गैस के द्रव्यमान की आवश्यकता होगी ?
उत्तर– जल में संहति के अनुसार हाइड्रोजन तथा ऑक्सीजन का अनुपात =1:8
1 g हाइड्रोजन पूर्णतया क्रिया करके जल बनाने के लिए आवश्यक ऑक्सीजन = 8 g
अतः 3 g हाइड्रोजन के पूर्णतया क्रिया करने के लिए आवश्यक ऑक्सीजन = 8 × 3 = 24 gl
प्रश्न 3. डाल्टन के परमाणु सिद्धान्त का कौन–सा अभिगृहीत द्रव्यमान के संरक्षण के नियम का परिणाम है?
उत्तर – डाल्टन के परमाणु सिद्धान्त का निम्नलिखित अभिगृहीत द्रव्यमान के संरक्षण नियम पर आधारित है-तत्त्व के परमाणुओं को किसी भी विधि द्वारा न तो नष्ट किया जा सकता है और न ही उत्पन्न किया जा सकता है।
प्रश्न 4. डाल्टन के परमाणु सिद्धान्त का कौन–सा अभिगृहीत निश्चित अनुपात के नियम की व्याख्या करता है?
उत्तर– डाल्टन के परमाणु सिद्धान्त का निम्नलिखित अभिगृहीत निश्चित अनुपात के नियम की व्याख्या करता है किसी भी यौगिक में परमाणुओं की सापेक्ष संख्या एवं प्रकार निश्चित होते हैं तथा भिन्न-भिन्न तत्त्वों के परमाणु परस्पर छोटी पूर्णसंख्या के अनुपात में संयोग कर यौगिक निर्मित करते हैं।
प्रश्न 5. परमाणु द्रव्यमान इकाई को परिभाषित कीजिए।
उत्तर – परमाणु द्रव्यमान इकाई– कार्बन 12 समस्थानिक के एक ।। परमाणु के द्रव्यमान के 1/12 वें भाग को परमाणु द्रव्यमान इकाई के रूप में लिया जाता है।
प्रश्न 6. एक परमाणु को आँखों द्वारा देखना क्यों संभव नहीं होता है?
उत्तर – परमाणु बहुत सूक्ष्म होते हैं। ये किसी भी वस्तु जिसकी हम कल्पना या तुलना कर सकते हैं, से भी बहुत छोटे होते हैं। लाखों परमाणुओं को जब एक के ऊपर एक चट्टे के रूप में रखें, तो बड़ी कठिनाई से कागज की एक शीट जितनी मोटी परत बन पाएगी। परमाणु का आकार लगभग 10-10 m होता है अतः हम इसे नगण्य मान सकते हैं जिसे आँखों द्वारा नहीं देख सकते।
प्रश्न 7. निम्न के सूत्र लिखिए –
(i) सोडियम ऑक्साइड
(ii) ऐलुमिनियम क्लोराइड
(iii) सोडियम सल्फाइड
(iv) मैग्नीशियम हाइड्रॉक्साइड
उत्तर–(i) सोडियम ऑक्साइड का सूत्र
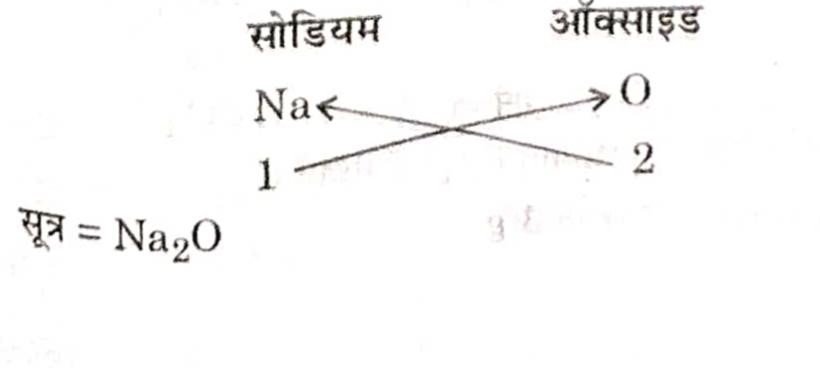
(ii) ऐलुमिनियम क्लोराइड का सूत्र
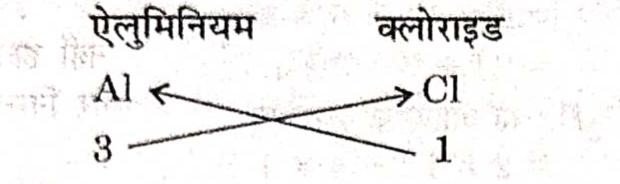
सूत्र = AlCl3
(iii) सोडियम सल्फाइड का सूत्र
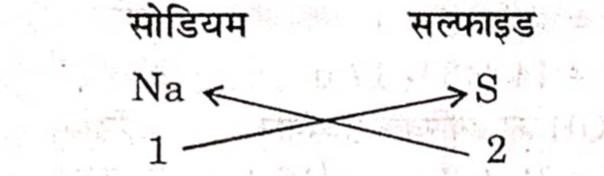
सूत्र = Na2S
(iv) मैग्नीशियम हाइड्रॉक्साइड का सूत्र

सूत्र = Mg(OH)2
प्रश्न 8. निम्नलिखित सूत्रों द्वारा प्रदर्शित यौगिकों के नाम लिखिए–
(i) Al2(SO4)3
(ii) CaCl2
(iii) K2SO4
(iv) KNO3
(v) CaCO3
उत्तर– (i) Al2(SO4)3-ऐलुमिनियम सल्फेट
(ii) CaCl₂-कैल्सियम क्लोराइड
(iii) K2SO4- पोटैशियम सल्फेट
(iv) KNO3- पोटैशियम नाइट्रेट
(v) CaCO3-कैल्सियम कार्बोनेट
प्रश्न 9. रासायनिक सूत्र का क्या तात्पर्य है?
उत्तर– किसी यौगिक का रासायनिक सूत्र उसके संघटक का प्रतीकात्मक निरूपण होता है।
प्रश्न 10. निम्न में कितने परमाणु विद्यमान हैं?
(i) H2S अणु एवं
(ii) PO43- आयन ?
उत्तर– (i) H2S में तीन परमाणु हैं।
(ii) PO₄ आयन में पाँच परमाणु हैं।
प्रश्न 11. निम्न यौगिकों के आण्विक द्रव्यमान का परिकलन कीजिए : H2, O2, C12, CO2, CH4, C2H6, C3H4, NH3 एवं CH3OH
उत्तर– (i) H2 का आण्विक द्रव्यमान
=2×1=2 น. उत्तर
(ii) 02 का आण्विक द्रव्यमान
2×1632 u. उत्तर
(iii) Cl₂ का आण्विक द्रव्यमान
= 2×35.5= 71 u.उत्तर
(iv) CO₂ का आण्विक द्रव्यमान
=12+2 * 16
=12+32= 44 u.उत्तर
(v) CH4 का आण्विक द्रव्यमान
=12+4×1
=12+4=16 u. उत्तर
(vi) C2H6 का द्रव्यमान
=2×12+6×1
=24+6 =30 น. उत्तर
(vii) C2H4 का आण्विक द्रव्यमान
=2×12+4×1
=24+4= 28 น. उत्तर
(viii) NH3 का आण्विक द्रव्यमान
= 14+3×1
14+3=17 u. उत्तर
(ix) CH3OH का आण्विक द्रव्यमान
=12+3×1+16+1
=12+3+16+1=32 น.उत्तर
प्रश्न 12. निम्नलिखित यौगिकों के सूत्र इकाई द्रव्यमान का परिकलन कीजिए–
ZnO, Na2O, K2CO3दिया गया है :
Zn का परमाणु द्रव्यमान = 65 u
Na का परमाणु द्रव्यमान = 23 u
K का परमाणु द्रव्यमान = 39 u
C का परमाणु द्रव्यमान = 12 u
O का परमाणु द्रव्यमान = 16 u
उत्तर– (i) ZnO का सूत्र इकाई द्रव्यमान
= 65+16= 81 u.उत्तर
(ii) Na2O का सूत्र इकाई द्रव्यमान
=2×23+16
46+16= 62 u. उत्तर
(iii) K2CO3 का सूत्र इकाई द्रव्यमान
=2×39+12+3 × 16
=78+12+48 = 138 น. उत्तर
प्रश्न 13. यदि कार्बन परमाणुओं के एक मोल का द्रव्यमान 12 g है तो कार्बन के एक परमाणु का द्रव्यमान क्या होगा ?
हल– 1 mol में परमाणुओं की संख्या
= 6.022 × 1023
6.022 × 1023 परमाणुओं का द्रव्यमान = 12 g
1 परमाणु का द्रव्यमान = 12/6.022*1023
=12000*10-23 /6022 उत्तर
प्रश्न 14. किसमें अधिक परमाणु होंगे: 100 g सोडियम अथवा 100 g लोहा (Fe) ? (Na का परमाणु द्रव्यमान = 23 u, Fe का परमाणु द्रव्यमान = 56 u)
हल– 1 mol सोडियम का द्रव्यमान = 23 g
100 g सोडियम में मोलों की संख्या = 100/23 =4.35mol
1 mol लोहे का द्रव्यमान =56g
100gलोहे में मोलों की संख्या = 100 /56 =1.8mol
क्योंकि 100 g सोडियम में मोलों की संख्या 100 g लोहे में मोलों की संख्या से अधिक है अतः 100 g सोडियम में अधिक परमाणु होंगे।
प्रश्न 15. 0.24 g ऑक्सीजन एवं बोरॉन युक्त यौगिक के नमूने में विश्लेषण द्वारा यह पाया गया कि उसमें 0.096 g बोरॉन एवं 0.144 g ऑक्सीजन है। उस यौगिक के प्रतिशत संघटन का भारात्मक रूप में परिकलन कीजिए।
उत्तर– यौगिक का कुल द्रव्यमान = 0.24 g
(i) बोरॉन की प्रतिशतता = बोरॉन का द्रव्यमान / यौगिक का द्रव्यमान × 100
= 0.096 / 0.24 × 100
= 40%
(ii) ऑक्सीजन की प्रतिशतता = ऑक्सीजन का द्रव्यमान / यौगिक का द्रव्यमान *100
=0.144 / 0.24 × 100
= 60%
प्रश्न16. 3.0 g कार्बन 8.00 g ऑक्सीजन में जलकर 11.00 g कार्बन डाइऑक्साइड निर्मित करता है। जब 3.00 g कार्बन को 50.0 g. ऑक्सीजन में जलाया जाता है तो कितने ग्राम कार्बन डाइऑक्साइड का निर्माण होगा। आपका उत्तर रासायनिक संयोजन के किस नियम पर आधरित होगा ?
उत्तर – क्योंकि 3.0 g कार्बन 8.0 g ऑक्सीजन में जलाया जाता है तो 11.0 g कार्बन डाइऑक्साइड प्राप्त होती है इसलिए 3.0 g कार्बन को जब 50.0 g ऑक्सीजन में जलाया जाएगा तो वह केवल 8.0 g ऑक्सीजन के साथ संयोग करके 11.0 g कार्बन डाइऑक्साइड बनाएगा। शेष (50 – 8 = 42 g) ऑक्सीजन बिना अभिक्रिया करे बची रहेगी। यह संहति के स्थिर अनुपात के नियम के अनुरूप है।
प्रश्न 17. बहुपरमाणुक आयन क्या होते हैं? उदाहरण दीजिए।
उत्तर – बहुपरमाणुक आयन– जब एक से अधिक तत्त्वों के परमाणु आपस में जुड़कर एक सामान्य धनावेशित या ऋणावेशित आयन बनाते हैं तो उन्हें बहुपरमाणुक आयन कहते हैं। सामान्यतः बहुपरमाण्विक आयन (ऋणावेशित) अधिक संख्या में पाए जाते हैं।
उदाहरण –
धनावेशित– अमोनियम आयन NH4+
ऋणावेशित– हाइड्रॉक्साइड OH- , नाइट्रेटNO3– , सल्फेटSO4-2 , कार्बोनेट CO3-2
प्रश्न 18. निम्नलिखित के रासायनिक सूत्र लिखिए :
(a) मैग्नीशियम क्लोराइड
(b) कैल्सियम क्लोराइड
(c) कॉपर नाइट्रेट
(d) ऐलुमिनियम क्लोराइड
(e) कैल्सियम कार्बोनेट।
उत्तर–(a) मैग्नीशियम क्लोराइड का सूत्र :
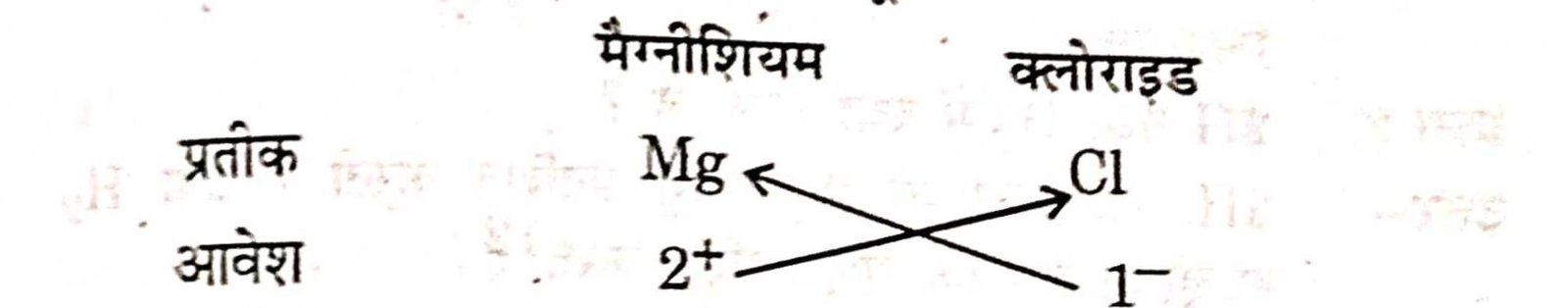
मैग्नीशियम क्लोराइड का सूत्र = Mg1 Cl₂ अथवा MgCl2
(b) कैल्सियम क्लोराइड का सूत्र :
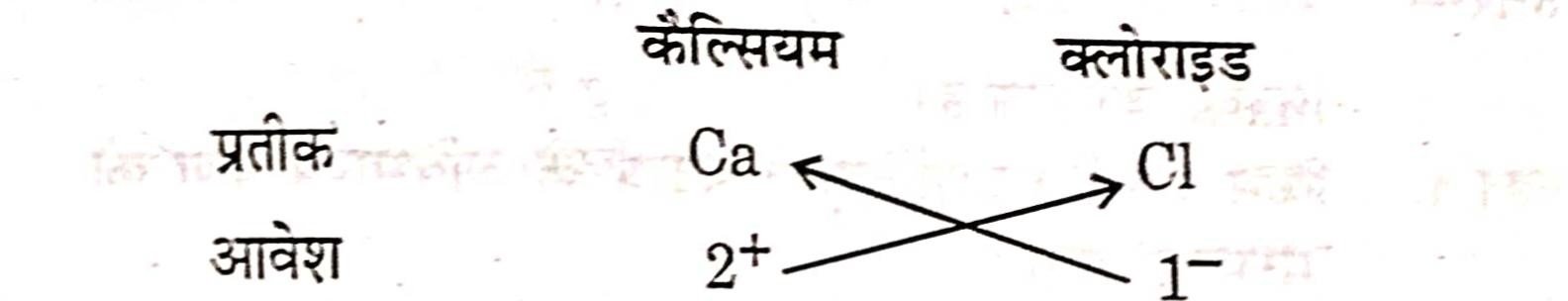
कैल्सियम क्लोराइड का सूत्र = Ca₁ Cl₂ अथवा CaCl2
(c) कॉपर नाइट्रेट का सूत्र :

कॉपर नाइट्रेट का सूत्र = Cu₁ (NO3)1 अथवा CuNO3.
(d) ऐलुमिनियम क्लोराइड का सूत्र :
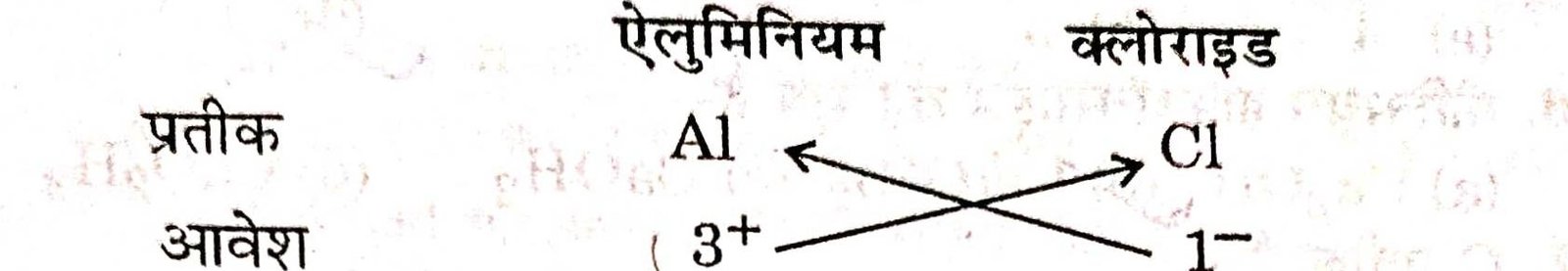
ऐलुमिनियम क्लोराइड का सूत्र = Al₁ Cl3 अथवा AlCl3
(e) कैल्सियम कार्बोनेट का सूत्र :
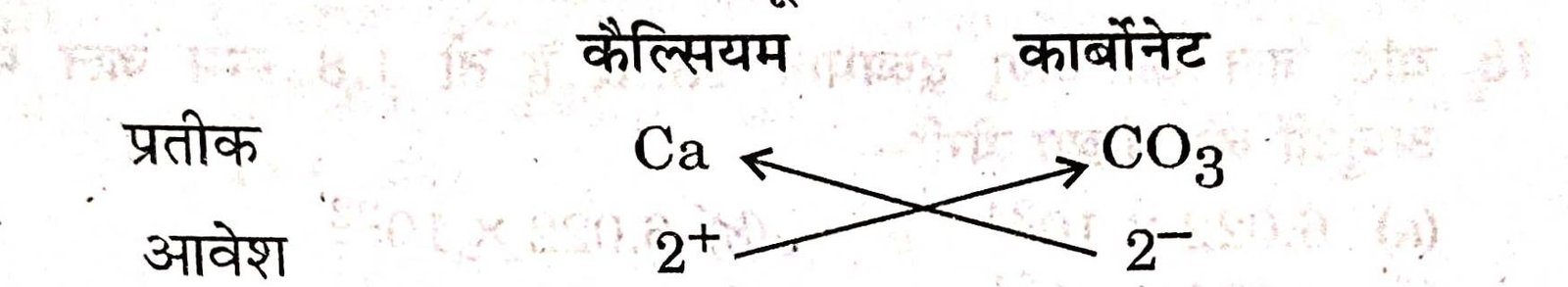
कैल्सियम कार्बोनेट का सूत्र = Ca2(CO3)2 अथवा CaCO3
प्रश्न19. निम्नलिखित यौगिकों में विद्यमान तत्त्वों का नाम दीजिए :
(a) बुझा हुआ चूना
(b) हाइड्रोजन ब्रोमाइड
(c) बेकिंग पाउडर (खाने वाला सोडा)
(d) पोटैशियम सल्फेट
उत्तर–
| यौगिक का नाम | रासायनिक सूत्र | उपस्थित तत्त्व |
| (a) बुझा हुआ चूना | CaO | कैल्सियम, ऑक्सीजन |
| (b) हाइड्रोजन ब्रोमाइड | HBr | हाइड्रोजन, ब्रोमीन सोडियम |
| (c) बेकिंग पाउडर | NaHCO3 | हाइड्रोजन कार्बन, |
| (d) पोटैशियम सल्फेट | K2SO4 | ऑक्सीजन सल्फर पोटैशियम, |