UP Board and NCERT Solution of Class 9 Science [विज्ञान] ईकाई 1 द्रव्य- प्रकृति एवं व्यवहार – Chapter-4 Structure Of The Atom (परमाणु की संरचना ) दीर्घ उत्तरीय प्रश्न Dirgh Uttareey Prashn
प्रिय पाठक! इस पोस्ट के माध्यम से हम आपको कक्षा 9वीं विज्ञान ईकाई 1 द्रव्य- प्रकृति एवं व्यवहार के अंतर्गत चैप्टर4 (परमाणु की संरचना) पाठ के दीर्घ उत्तरीय प्रश्न प्रदान कर रहे हैं। UP Board आधारित प्रश्न हैं। आशा करते हैं कि पोस्ट आपको पसंद आयेगी अगर पोस्ट आपको पसंद आई तो इसे अपने दोस्तों के साथ में जरुर शेयर करें

| Class | 9th | Subject | Science (Vigyan) |
| Pattern | NCERT | Chapter- | Structure Of The Atom |
दीर्घ उत्तरीय प्रश्न / Dirgh Uttareey Prashn
प्रश्न 1. इलेक्ट्रॉन वितरण की बोर-बरी योजना क्या है ? इसके अनुसार इलेक्ट्रॉनों की व्यवस्था लिखिए।
उत्तर- इलेक्ट्रॉन वितरण की बोर-बरी योजना – इलेक्ट्रॉन वितरण के लिए बोर-बरी ने निम्न योजना प्रस्तुत की जिसे बोर-बरी की योजना कहते हैं। इसके प्रमुख बिन्दु निम्नलिखित हैं-
(i) परमाणु की किसी भी कक्षा में इलेक्ट्रॉनों की अधिकतम संख्या 2n2 होती है, जहाँ n कक्षा की क्रम संख्या है जो नाभिक से बाहर की ओर गिनी जाती है। इस तरह इलेक्ट्रॉनों की अधिकतम संख्या पहली कक्षा में 2, दूसरी में 8, तीसरी में 18, चौथी में 32 एवं पाँचवीं में 50 होती है।
(ii) सबसे बाहर वाली कक्षा में 8 एवं उसके अन्दर वाली कक्षा में 18 से अधिक इलेक्ट्रॉन कभी नहीं हो सकते।
(iii) किसी कक्षा में 8 इलेक्ट्रॉन होने पर नई कक्षा प्रारम्भ हो जाती है चाहे उसकी अधिकतम सीमा कुछ भी हो।
(iv) सबसे बाहर की कक्षा में 2 से अधिकं और उसके अन्दर वाली कक्षा में 8 से अधिक इलेक्ट्रॉन तब तक नहीं होते जब तक अन्य अन्दर की कक्षाएँ 2n² से पूर्ण न हो जायें।
प्रश्न 2. क्लोरीन तत्त्व (35/17 Cl) एवं ऑर्गन तत्त्व (40/18Ar) के उदाहरण से इनकी परमाणु संरचना का मॉडल बनाइये।
हल-क्लोरीन तत्त्व (35/17 Cl)की परमाणु संरचना –

क्लोरीन का परमाणु क्रमांक Z = 17
क्लोरीन की द्रव्यमान संख्या A = 35
प्रोटॉन की संख्या p = Z = 17
न्यूट्रॉन की संख्या n =A-Z
35-17=18
इलेक्ट्रॉन की संख्या e = p = 17
इलेक्ट्रॉन का वितरण e = 17 → 2, 8, 7
40 Ar (ऑर्गन तत्त्व) की परमाणु संरचना –

18 ऑर्गन का परमाणु क्रमांक Z = 18
ऑर्गन की द्रव्यमान संख्या A = 40
प्रोटॉन की संख्या p =18
न्यूट्रॉन की संख्या n = A-Z
= 40-18
= 22
इलेक्ट्रॉन की संख्या e = p = 18
इलेक्ट्रॉन का वितरण e = 18 = 2, 8, 8
प्रश्न 3. दो तत्त्वों A और B के परमाणुओं के अवपरमाणुक कण नीचे दिए गए हैं। उसका अध्ययन कीजिए तथा निम्न प्रश्नों के उत्तर दीजिए। अपने उत्तर की सत्यता सिद्ध कीजिए।
| तत्त्व | प्रोटॉन | इलेक्ट्रॉन | न्यूट्रॉन |
| A | 2 | 2 | 2 |
| B | 11 | 11 | 12 |
(i) दोनों में से किसके परमाणु का आकार बड़ा है?
(ii) दोनों में से किसका नाभिक प्रबल है?
(iii) तत्त्व A तथा B की प्रकृति की व्याख्या कीजिए।
उत्तर-(i) B के परमाणु का आकार बड़ा है क्योंकि B में तीन कोश होते हैं जबकि A में एक कोश होता है।
(ii) B का नाभिक प्रबल है क्योंकि A की द्रव्यमान संख्या 2+2= 4 है जबकि B की द्रव्यमान संख्या 11+ 12 = 23 है।
(iii) A अधातु है जबकि B धातु है। A गैस है तथा B के बाह्यतम कोश में एक इलेक्ट्रॉन है जिसका यह आसानी से त्याग कर सकता है।
प्रश्न 4. (a) रदरफोर्ड के अल्फा कण प्रकीर्णन प्रयोग में निम्न निष्कर्ष व्युत्पन्न करने के लिए प्रायोगिक प्रमाण दीजिए:
- परमाणु के भीतर का अधिकतर भाग खाली होता है।
- परमाणु का केन्द्र धनावेशित होता है।
(b) एक तत्त्व की द्रव्यमान संख्या 32 तथा परमाणु संख्या 16 है, ज्ञात कीजिए :
(i) तत्त्व के परमाणु में न्यूट्रॉनों की संख्या।
(ii) परमाणु के बाह्यतम कोश में इलेक्ट्रॉनों की संख्या।
(c) रदरफोर्ड के परमाण्वीय मॉडल के आधार पर नाभिक में कौन-सा अवपरमाणुक कण विद्यमान होता है?
उत्तर-(a) (i) परमाणु के भीतर का अधिकतर भाग खाली होता है क्योंकि अधिकतर अल्फा कण बिना विक्षेपित हुए सोने की पन्नी को पार कर सीधे निकल जाते हैं।
(ii) कुछ -कण अपने मूल पथ से थोड़ा विक्षेपित हो जाते हैं इससे सिद्ध होता है कि परमाणु का केन्द्र धनावेशित भाग है।
(b) तत्त्व की द्रव्यमान संख्या = 32
तत्त्व की परमाणु संख्या = 16
- प्रोटॉनों की संख्या = परमाणु संख्या = 16
न्यूट्रॉनों की संख्या = द्रव्यमान संख्या – प्रोटॉनों की संख्या =32-16=16
- तत्त्व का इलेक्ट्रॉन विन्यास = 2, 8, 6
परमाणु के बाह्यतम कोश में इलेक्ट्रॉनों की संख्या= 6
(c) प्रोटॉन।
प्रश्न 5. (a) उस अवपरमाणुक कण का नाम लिखिए जिसकी खोज जे, चैडविक ने की थी। इस कण पर कौन-सा आवेश होता है? यह कण परमाणु के कौन-से भाग में स्थित होता है ?
(b) रदरफोर्ड के परमाणु मॉडल के प्रयोग के तीन चरणों की सूची बनाइए।
(c) एक उदाहरण देते हुए समभारिक परमाणु की परिभाषा लिखिए।
(d) यह निष्कर्ष किस वैज्ञानिक ने निकाला था कि परमाणु की अपेक्षा नाभिक का साइज बहुत छोटा होता है।
उत्तर-(a) जे. चैडविक ने न्यूट्रॉन की खोज की थी। न्यूट्रॉन अनावेशित होता है। यह कण परमाणु के नाभिक में होता है।
(b) (i) रदरफोर्ड ने रेडियोऐक्टिव तत्त्व रेडियम को लैंड के बॉक्स के भीतर रखकर प्राप्त अल्फा कणों को एक बारीक स्लिट
से गुजारकर इन्हें पुंज के रूप में प्राप्त किया। (ii) इस पुंज को उन्होंने एक भारी धातु, जैसे-गोल्ड के अत्यन्त पतली पन्नी पर डाला।
(iii) इससे ये अल्फा कण प्रकीर्णित हो गए तथा बहुत-से अल्फा कण पन्नी से पार होकर पीछे लगे जिंक सल्फाइड के मध्य जाकर टकरा गए।
(c) समभारिक- समभारिक, विभिन्न परमाणु संख्याओं परन्तु समान द्रव्यमान संख्या वाले विभिन्न तत्त्वों के परमाणु हैं। समभारिकों में, उनके नाभिकों में प्रोटॉनों की भिन्न संख्या होती है परन्तु उनमें न्यूक्लिऑनों (प्रोटॉनों न्यूट्रॉनों) की संख्या समान होती है। समभारिकों के उदाहरण
ऑर्गन 40/18 Ar और कैल्सियम 40 /20 Ca है।
(d) रदरफोर्ड ने निष्कर्ष निकाला था कि परमाणु की अपेक्षा नाभिक का साइज बहुत छोटा होता है।
प्रश्न 6. संयोजकता इलेक्ट्रॉन का महत्त्व लिखिए व तत्त्व की संयोजकता निर्धारण में इसकी भूमिका बताइए।
उत्तर-संयोजकता-किसी तत्त्व के परमाणु द्वारा दिए जाने, लिये जाने या साझेदारी किए जाने वाले इलेक्ट्रॉन की संख्या, उस तत्त्व की संयोजकता कहलाती है।
हम जानते हैं कि किसी रासायनिक अभिक्रिया में केवल बाहातम कक्ष में उपस्थित इलेक्ट्रॉन या संयोजकता इलेक्ट्रॉन ही भाग लेते हैं। अतः संयोजकता निर्धारण में संयोजकता इलेक्ट्रॉन ही महत्वपूर्ण होते हैं। यदि किसी तत्त्य के परमाणु के संयोजकता इलेक्ट्रॉन 1, 2 या 3 हैं तो उसकी संयोजकता क्रमशः 1.2 या 3 होगी। यदि तत्त्व के बाह्यतम कक्ष में 4 से 8 इलेक्ट्रॉन हैं तो उसकी संयोजकता (संयोजकता इलेक्ट्रॉन -8) होगी।
उदाहरणार्थ- क्लोरीन या फ्लोरीन के बाह्यतम कक्ष में 7 इलेक्ट्रॉन हैं, तब उनकी संयोजकता 7-8=1 होगी। अतः क्लोरीन या फ्लोरीन के आयन को CI–या F– से प्रदर्शित करेंगे।
प्रश्न 7. रदरफोर्ड के प्रयोग के प्रेक्षणों का विवरण दीजिए तथा परमाणु के रदरफोर्ड मॉडल की परिकल्पनाएँ लिखिए।
उत्तर-रदरफोर्ड का अल्फा-कणों के प्रकीर्णन का प्रयोग-परमाणु की आन्तरिक संरचना का ज्ञान प्राप्त करने के लिए रदरफोर्ड ने कुछ महत्त्वपूर्ण प्रयोग किये। इन प्रयोगों में अल्फा-कणों के एक पतले किरण पुंज (beam) की बौछार धातु स्वर्ण की अत्यधिक पतली पन्नियों (foils) पर की गयी तथा स्वर्ण के परमाणुओं से अल्फा-कणों की टक्करों के परिणाम का अध्ययन किया गया। स्वर्ण-पत्र की मोटाई लगभग 10-7 m थी, जिससे यह निश्चित होता था कि अल्फा-कण की टक्कर एक या दो स्वर्ण-परमाणुओं से ही हो।
प्रयोग द्वारा प्राप्त प्रमुख प्रेक्षण निम्नवत् थे-
(1)अधिकांश अल्फा कण धातु पत्र को पार कर सीधे निकल जाते हैं। इससे यह निष्कर्ष मिलता है कि परमाणु का अधिकांश स्थान रिक्त होता है, जिससे अल्फा-कण बिना किसी टक्कर के सीधे निकल जाते हैं।

(2) कुछ अल्फा कण अपने मार्ग से विभिन्न दिशाओं में इस प्रकार मुड़ जाते हैं जैसे कि वे किसी छोटे कण द्वारा प्रतिकर्षित हो रहे हों।
(3) अल्फा-कणों में से कुछ (लगभग 12,000 में से 1) कण अपने ही मार्ग पर वापस लौट आते हैं, जैसे कि वे किसी अन्य कण से टकरा कर प्रतिकर्षित हुए हीं।
उपर्युक्त प्रेक्षण (2) तथा (3) से यह निष्कर्ष प्राप्त हुआ कि परमाणु के केन्द्र में एक अत्यन्त सूक्ष्म तथा धनावेशित कण उपस्थित है जो निकट आने वाले धनावेशित अल्फा-कणों को प्रतिकर्षित करके विक्षेपित कर देता है। कुछ अल्फा-कण इसी केन्द्रीय कण से सीधे टकरा कर वापस लौट जाते हैं। चूंकि वापस लौटने वाले अल्फा-कणों की संख्या बहुत कम होती है, अतः परमाणु के केन्द्रीय भाग का आकार परमाणु की अपेक्षा बहुत कम होना चाहिए।
रदरफोर्ड के परमाणु मॉडल की परिकल्पनाएँ– रदरफोर्ड के परमाणु- मॉडल की परिकल्पनाएँ निम्नवत् हैं-
(1) परमाणु में उपस्थित समस्त धन आवेश तथा द्रव्यमान का अधिकांश भाग (लगभग 99.95%) एक अति सूक्ष्म आयतन में केन्द्रित है जिसे नाभिक कहते हैं। नाभिक का व्यास 10m से लेकर 10 m की कोटि का होता है, जबकि परमाणु का व्यास 100 m (1A) की कोटि का होता है।
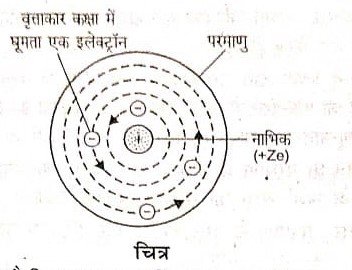
इससे स्पष्ट है कि परमाणु का अधिकांश आयतन रिक्त स्थान होता है।
(2) नाभिक के चारों ओर लगभग 10-10 m त्रिज्या के गोले में इलेक्ट्रॉन वितरित रहते हैं।
(3) नाभिक के बाहर स्थित इलेक्ट्रॉनों के समस्त ऋणावेश की मात्रा नाभिक के धनावेश की मात्रा के बराबर होती है जिससे सामान्यतः परमाणु विद्युत-उदासीन होता है।
(4) इलेक्ट्रॉन स्थिर नहीं रहते वरन् नाभिक के चारों ओर वृत्ताकार कक्षाओं में घूमते रहते हैं। नाभिक तथा इलेक्ट्रॉन के बीच विद्युत- आकर्षण का बल (कूलॉम), पूर्णन के लिए आवश्यक अभिकेन्द्रीय बल का कार्य करता है।
प्रश्न 8. रदरफोर्ड के परमाणु मॉडल की प्रमुख कमियाँ क्या थीं?
उत्तर-रदरफोर्ड मॉडल की कमियाँ परमाणु के रदरफोर्ड मॉडल में मुख्यतः दो कमियाँ पायी गयीं-
(1) परमाणु का स्थायित्व– रदरफोर्ड मॉडल के अनुसार, इलेक्ट्रॉन नाभिक के चारों ओर घूमता है अर्थात् इलेक्ट्रॉन में (अभिकेन्द्रीय) त्वरण होता है। अब परम्परागत वैद्युत-गति-विज्ञान के अनुसार, त्वरित इलेक्ट्रॉन, विद्युत्- चुम्बकीय तरंगों के रूप में ऊर्जा का उत्सर्जन करता रहेगा, जिससे इलेक्ट्रॉन की ऊर्जा कम होती जायगी। ऊर्जा कम होने से, परम्परागत यांत्रिकी के नियमों के अनुसार, इलेक्ट्रॉन की कक्षा की त्रिज्या कम होती जायगी तथा घूर्णन-दर बढ़ती जायगी।

अतः इलेक्ट्रॉन घटती हुई त्रिज्या में घूमते हुए एक सर्पिल मार्ग में गति करता हुआ नाभिक के निकट आता जायगा तथा अंततः नाभिक में गिर जायेगा। इससे परमाणु का अस्तित्व ही समाप्त हो जाएगा। यांत्रिकी के नियमों के अनुसार यह क्रिया 10-8 में पूरी हो जायेगी अतः कोई भी परमाणु अपने निर्माण के 10-8 S बाद ही नष्ट हो जाएगा।
परन्तु परमाणु पूर्णतः स्थायी पाये जाते हैं। अतः रदरफोर्ड का परमाणु- मॉडल परमाणु के स्थायित्व की व्याख्या नहीं कर सकता।
(2) परमाणु का रेखीय स्पेक्ट्रम– जैसा कि पहले कहा जा चुका है. घूर्णन करने वाले इलेक्ट्रॉन की घूर्णन-दर क्रमशः बढ़ती जायगी। इससे इलेक्ट्रॉन द्वारा उत्सर्जित तरंगों की आवृत्ति सतत रूप से बढ़ती जायगी अर्थात् परमाणु द्वारा उत्सर्जित विकिरणों का स्पेक्ट्रम सतत होगा जिसमें रंगों का परिवर्तन सतत रूप से अवरक्त (ऊष्मा) विकिरणों से प्रकाश, पराबैंगनी आदि से होते हुए गामा- विकिरणों तक फैला होगा।
परन्तु प्रयोग द्वारा परमाणुओं के स्पेक्ट्रमों में केवल कुछ सुनिश्चित आवृत्तियों की एक-दूसरे से अलग रेखाएँ ही प्राप्त होती हैं। इस प्रकार रदरफोर्ड का परमाणु-मॉडल रेखीय-स्पेक्ट्रमों की भी व्याख्या नहीं कर सकता।
प्रश्न 9. परमाणु के बोर मॉडल की परिकल्पनाएँ लिखिए तथा परंमाणु के ऊर्जा-स्तरों का संक्षिप्त विवरण दीजिए।
उत्तर- परमाणु के बोर मॉडल की परिकल्पनाएँ-परमाणु के बोर मॉडल की संकल्पनाएँ निम्नवत् हैं-
(1) नाभिक के चारों ओर घूमने वाला इलेक्ट्रॉन केवल कुछ विशेष त्रिज्याओं की कक्षाओं में ही घूर्णन कर सकता है।
सामान्यतः इलेक्ट्रॉन अपनी कक्षा परिवर्तित नहीं कर सकता। अतः इन्हें स्थायी कक्षाएँ कहते हैं। इनके अतिरिक्त किसी अन्य कक्षा में इलेक्ट्रॉन का रहना सम्भव नहीं है।
(2) किसी स्थायी कक्षा में घूमते हुए इलेक्ट्रॉन का कोणीय संवेग का मान राशि 1/2 का केवल पूर्ण-गुणित ही हो सकता है। अर्थात् स्थायी कक्षा में घूमते हुए इलेक्ट्रॉन का वेग इस प्रकार होता है कि उसका कोणीय संवेग h/2 π, 2h/2 π, 3h/2π…….n (h/2 π) ही हो सकता है, जबकि = 1. 2,3,…∞
(h एक नियतांक है जिसे प्लांक-नियतांक (Planck’s Constant) कहते हैं। इसका मान 6.67×10-34 J-s-1 होता है।)
(3) स्थायी कक्षा में घूमता हुआ इलेक्ट्रॉन विकिरण-ऊर्जा का उत्सर्जन नहीं करता। [अतः सामान्यतः परमाणु स्थायी बना रहता है।]
(4) किसी बाह्य स्त्रोत से ऊर्जा प्राप्त होने पर इलेक्ट्रॉन कुछ निश्चित मात्राओं में ही ऊर्जा का अवशोषण कर सकता है। इस ऊर्जा- अवशोषण से इलेक्ट्रॉन अपने सामान्य ऊर्जा-स्तर की कक्षा से किसी उच्चतर ऊर्जा की कक्षा में चला जाता है। यह क्रिया तभी सम्भव है जब अवशोषित ऊर्जा की मात्रा दो कक्षाओं के ऊर्जा-स्तरों के अन्तर के बराबर हो। चूंकि कक्षाओं की ऊर्जाएं सुनिश्चित होती हैं, ऊर्जा का अवशोषण भी सुनिश्चित मात्राओं में ही हो सकता हैं।
(5) ऊर्जा-अवशोषण के द्वारा उच्चतर कक्षा में गया हुआ इलेक्ट्रॉन लगभग तुरन्त ही किसी निम्नतर ऊर्जा की कक्षा में वापस लौटता है। इस क्रिया में परमाणु से ठीक उतनी ही ऊर्जा, (क्वाण्टम या फोटॉन के रूप में) उत्सर्जित होती है, जो दोनों कक्षाओं की ऊर्जाओं के अन्तर के बराबर हो।
चूँकि उत्सर्जित फोटॉनों की आवृत्ति, उसकी ऊर्जा पर निर्भर करती है, परमाणु द्वारा उत्सर्जित विकिरण केवल कुछ निश्चित आवृत्तियों के होते हैं। इससे परमाणु द्वारा उत्सर्जित विकिरणों का स्पेक्ट्रम रेखीय होता है।
परमाणु के ऊर्जा-स्तर-बोर के परमाणु-रचना के सिद्धान्त के अनुसार, इलेक्ट्रॉन नाभिक के चारों ओर कुछ निश्चित कक्षाओं में ही परिक्रमा कर सकते हैं जिन्हें स्थिर कक्षा कहते हैं। इन कक्षाओं की त्रिज्या निश्चित होती है तथा इनमें परिक्रमा करने वाले इलेक्ट्रॉनों की एक निश्चित ऊर्जा होती है।

अतः इन कक्षाओं को ऊर्जा-स्तर कहते हैं। नाभिक से प्रारम्भ करके इन कक्षाओं को 1,2,3,4,… आदि अंकों अथवा K, L, M, N,… आदि अक्षरों से प्रदर्शित करते हैं। 1,2,3,4 आदि अंकों को कक्षा की मुख्य क्वाण्टम संख्या कहते हैं और n से निरूपित करते हैं। नाभिक के तुरन्त बाद वाली कक्षा के लिए मुख्य क्वाण्टम संख्या n = 1 होती है। इसे पहली कक्षा कहते हैं और इस पहली कक्षा में परिक्रमा करने वाले इलेक्ट्रॉनों की ऊर्जा सबसे कम होती है। इन कक्षाओं को कोश भी कहते हैं। जैसे K कक्षा को K-कोश, L कक्षा को L-कोश आदि कहते हैं।