UP Board and NCERT Solution of Class 9 Science [विज्ञान] ईकाई 1 द्रव्य- प्रकृति एवं व्यवहार – Chapter-4 Structure Of The Atom (परमाणु की संरचना ) लघु उत्तरीय प्रश्न Laghu Uttareey Prashn
प्रिय पाठक! इस पोस्ट के माध्यम से हम आपको कक्षा 9वीं विज्ञान ईकाई 1 द्रव्य- प्रकृति एवं व्यवहार के अंतर्गत चैप्टर4 (परमाणु की संरचना) पाठ के लघु उत्तरीय प्रश्न प्रदान कर रहे हैं। UP Board आधारित प्रश्न हैं। आशा करते हैं कि पोस्ट आपको पसंद आयेगी अगर पोस्ट आपको पसंद आई तो इसे अपने दोस्तों के साथ में जरुर शेयर करें

| Class | 9th | Subject | Science (Vigyan) |
| Pattern | NCERT | Chapter- | Structure Of The Atom |
लघु उत्तरीय प्रश्न / Laghu Uttareey Prashn
प्रश्न 1. टॉमसन के परमाणु मॉडल के दो मुख्य अभिगृहीतियाँ बताइये।
उत्तर- (i) परमाणु धन आवेशित गोले का बना होता है और इलेक्ट्रॉन उसमें धँसे होते हैं। (ii) ऋणात्मक और धनात्मक आवेश परिमाण में समान होते हैं। इसलिए परमाणु वैद्युतीय रूप से उदासीन होते हैं।
प्रश्न 2. समस्थानिक तथा समभारिक में दो अन्तर लिखिए।
उत्तर- समस्थानिक (Isotopes) -(1) परमाणु संख्या समान लेकिन द्रव्यमान संख्या भिन्न होती है। (2) प्रोटॉनों की संख्या समान होती है।
समभारिक(Isobars)- (1) परमाणु संख्या अलग-अलग होती है लेकिन द्रव्यमान संख्या समान होती है। (2) प्रोटॉनों की संख्या भिन्न होती है।
प्रश्न 3. निम्नलिखित सारणी में कुछ तत्त्वों की द्रव्यमान संख्या तथा परमाणु संख्या दी गई है :
| तत्त्व | A | B | C | D | E |
| द्रव्यमान संख्या | 1 | 7 | 14 | 40 | 40
|
| परमाणु संख्या | 1 | 3 | 7 | 18 | 20 |
(a) उपर्युक्त सारणी से एक जोड़ा समभारिक चुनिए।
(b) उपर्युक्त सारणी में दिये गए तत्त्व ‘B’ की संयोजकता क्या होगी?
उत्तर- (a) D तथा E समभारिक हैं क्योंकि इनकी परमाणु संख्याएँ (40) परन्तु भिन्न-भिन्न द्रव्यमान संख्याएँ क्रमशः 18 तथा 20 हैं।
(c) B का इलेक्ट्रॉनिक विन्यास = 2, 5
अतः B की संयोजकता = 3
प्रश्न 4. एक तत्व ‘X’ का इलेक्ट्रॉनिक विन्यास 2, 8,2%
(A) इलेक्ट्रॉन की संख्या ज्ञात कीजिए जो तत्त्व X में उपस्थित है।
(b) इसकी परमाणु संख्या लिखिए।
(c) चाह तत्त्व’ एक धातु है या अधातु? (d) तत्त्व X. की संयोजकता। ज्ञात कीजिए।
हल- (a) X में उपस्थित इलेक्ट्रॉनों की संख्या =2+8+2-12
(b) X की परमाणु संख्या = 12
(c) तत्त्व X एक पातु है।
(d) X की संयोजकता. = 2
प्रश्न 5. (a) नीचे दी गई स्पीशीज में किसमें 18 इलेक्ट्रॉन हैं?
Ca2+, K+, Na, Cl, Ar
(b) किसी तत्त्व के सभी समस्थानिकों के रासायनिक गुण एकसमान होते हैं। कारण लिखिए।
उत्तर- (a) Ca2+, K+, Na, Cl, Ar
(b) समस्थानिकों में इलेक्ट्रॉनों की संख्या समान है, तब उनका इलेक्ट्रॉन विन्यास तथा संयोजकता इलेक्ट्रॉन की संख्या भी समान होगी। अतः समस्थानिकों के रासायनिक गुण एकसमान होते हैं।
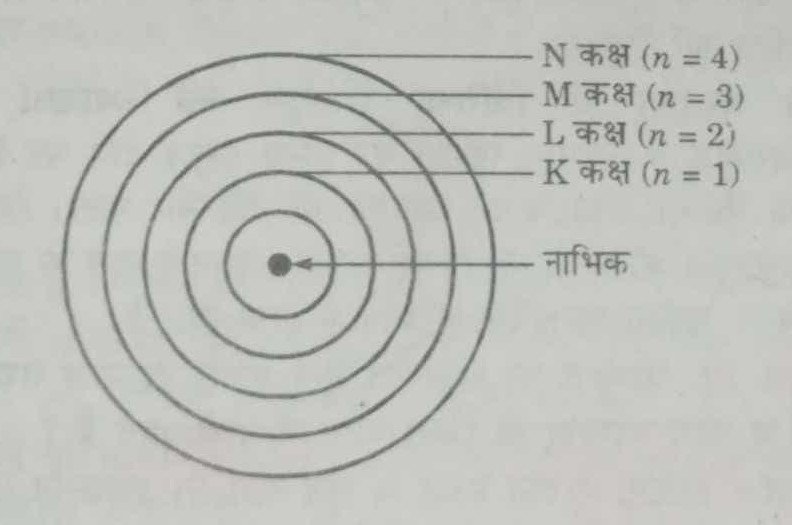
प्रश्न 6. नील बोर द्वारा अपने परमाणु मॉडल में शामिल नई संकल्पनाएँ बताइए। इस मॉडल को दिखाने के लिए एक रेखाचित्र खाँचिए।
उत्तर- बोर के परमाणु मॉडल में शामिल नई संकल्पनाएँ निम्नलिखित हैं-
(i) निश्चित ऊर्जायुक्त कुछ खास कक्षाएँ ही स्वीकार्य हैं।
(ii) जब तक कोई इलेक्ट्रॉन कण ऊर्जा स्तर में गतिशील है, इसमें ऊर्जा की हानि या लाभ नहीं होता।
(iii) जब इलेक्ट्रॉन ऊर्जा ग्रहण करते हैं तो उच्च ऊर्जा स्तर में पहुँच जाते हैं। जब ऊर्जा की हानि होती है तो निम्न ऊर्जा स्तर पर आ जाते हैं। इसे चित्र द्वारा दिखाया गया है।
प्रश्न 7. एक तत्त्व 8 16X के रूप में निरूपित होता है। ज्ञात कीजिए-
(a) तत्त्व X में इलेक्ट्रॉनों की संख्या, (b) तत्त्व X की द्रव्यमान संख्या, (c) तत्त्व X में न्यूट्रॉनों की संख्या।
हल- (a) तत्त्व X में इलेक्ट्रॉनों की संख्या=8
(b) तत्त्व X की द्रव्यमान संख्या = 16
(c) तत्त्व X में न्यूट्रॉनों की संख्या = 16-8=8
प्रश्न 8. (a) किसी परमाणु के तीन अवपरमाणुक कणों के नाम लिखिए।
(b) किसी तत्त्व में परमाणु की L कक्षा में पाँच इलेक्ट्रॉन हैं-
(i) तत्त्व की परमाणु संख्या क्या है?
(ii) इसकी संयोजकता व्यक्त कीजिए।
(iii) तत्त्व को पहचानिए तथा इसका नाम लिखिए।
हल- (a) किसी परमाणु के तीन अवपरमाणुक कणों के नाम हैं: इलेक्ट्रॉन, प्रोटॉन तथा न्यूट्रॉन।
(b) K कोश में इलेक्ट्रॉनों की संख्या = 2
L कोश में इलेक्ट्रॉनों की संख्या = 5
(i) तत्त्व की परमाणु संख्या 2+5 =7
(ii) तत्त्व की संयोजकता =3
(iii) तत्त्व नाइट्रोजन (N) है।
प्रश्न 9. (a) हीलियम तथा बेरीलियम दोनों में ही संयोजकता कक्षा में 2 इलेक्ट्रॉन होते हैं। हीलियम एक अक्रिय गैस है जबकि बेरीलियम एक धातु है। पुष्टि कीजिए।
(b) हाइड्रोजन का अस्तित्व तीन समस्थानिक रूपों में होता है। हाइड्रोजन के समस्थानिक रासायनिक रूप से समान क्यों होते हैं?
उत्तर- (a) हीलियम के बाह्यतम कक्ष में इलेक्ट्रॉनों की संख्या उसकी अधिकतम संख्या के बराबर है अतः हीलियम एक अक्रिय गैस है। बेरीलियम तत्त्व धातु है क्योंकि यह इलेक्ट्रॉन त्याग करके धनात्मक आयन बनाता है।
(b) समस्थानिकों में इलेक्ट्रॉनों की संख्या समान है। अतः उनका इलेक्ट्रॉन विन्यास और संयोजकता इलेक्ट्रॉन की संख्या भी समान होती है। अतः हाइड्रोजन के समस्थानिक रासायनिक रूप से समान होते हैं।
प्रश्न 10. समस्थानिक और समभारिक क्या होते हैं? क्लोरीन के दो समस्थानिक कौन-कौन से हैं? क्लोरीन के प्राकृतिक नमूने में इनका क्या अनुपात होता है? क्लोरीन परमाणु का औसत परमाणु द्रव्यमान परिकलित कीजिए।
उत्तर- समस्थानिक-एक ही तत्त्व के परमाणु जिनकी परमाणु संख्या समान तथा द्रव्यमान भिन्न होता है, समस्थानिक कहलाते हैं।
समभारिक– वे परमाणु जिनकी द्रव्यमान संख्या समान होती है परन्तु परमाणु क्रमांक भिन्न होते हैं, समभारिक कहलाते हैं।
क्लोरीन के दो समस्थानिक 17Cl35 तथा 17Cl37
प्रकृति में क्लोरीन के समस्थानिक 17Cl35 तथा 17Cl37 3:1 (या 75% और 25%) के अनुपात में पाये जाते हैं। इसलिए क्लोरीन परमाणु का औसत परमाणु द्रव्यमान
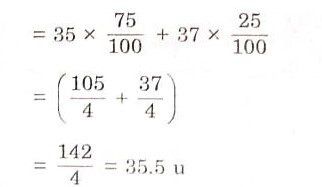
प्रश्न 11. परमाणु नाभिक के आवश्यक गुणधर्मो की व्याख्या कीजिए।
उत्तर-परमाणु नाभिक के गुणधर्म:
(i) परमाणु नाभिक धनावेश युक्त होता है।
(ii) परमाणु का सम्पूर्ण द्रव्यमान उसके नाभिक में ही स्थित होता है।
(iii) परमाणु नाभिक को त्रिच्या 10-13 में 10-12 cm होती है, जबकि सम्पूर्ण परमाणु को त्रिज्या लगभग 10-8 cm होती है। अतः परमाणु का अधिकांश भाग रिक्त होता है।
प्रश्न 12. टॉमसन परमाणु मॉडल, रदरफोर्ड परमाणु मॉडल तथा बोर परमाणु मॉडलों की तुलना कीजिए।
उत्तर- टॉमसन परमाणु मॉडल– टॉमसन ने तरबूज के समान परमाणु मॉडल प्रस्तावित किया जिसमें परमाणु का धनावेश तरबूज के खाने वाले भाग की भाँति फैला हुआ है, जबकि इलेक्ट्रॉन (ऋणावेश) धनावेशित गोले में तरबूज के बीज की भाँति धँसे हैं। ऋणावेश तथा धनावेश परिमाण में समान होते हैं। इसलिए परमाणु विद्युतीय उदासीन होता है।
रदरफोर्ड परमाणु मॉडल– इसके अनुसार, परमाणु में धनावेशित केन्द्र, जिसे नाभिक कहते हैं, होता है और इलेक्ट्रॉन स्थिर कक्षा में चक्कर लगाते हैं। नाभिक का आकार, परमाणु के आकार की तुलना में अत्यन्त कम या उपेक्षणीय होता है।
बोर परमाणु मॉडल– बोर परमाणु मॉडल के अनुसार इलेक्ट्रॉन केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं, जिन्हें इलेक्ट्रॉनॉ की विविक्त कक्षा कहते हैं। जब इलेक्ट्रॉन इन विविक्त कक्षाओं में चक्कर लगाते हैं तो उनकी ऊर्जा का विकिरण नहीं होता।
प्रश्न 13. सिलिकॉन और ऑक्सीजन का उदाहरण लेते हुए संयोजकता की परिभाषा दीजिए।
उत्तर-परमाणु के अन्तिम कोश (बाह्यतम कोश) में विद्यमान इलेक्ट्रॉन, संयोजी इलेक्ट्रॉन कहलाते हैं। किसी परमाणु द्वारा स्थायित्व (अष्टक) प्राप्त करने के लिए, त्यागे गए या प्राप्त या साझा किए गए इलेक्ट्रॉनों की संख्या, उसकी संयोजकता कहलाती है। परमाणु द्वारा अष्टक पूरा करने की क्रिया में संयोजी इलेक्ट्रॉनों का ही स्थानान्तरण या साझा होता है अर्थात् संयोजी इलेक्ट्रॉन ही परमाणु की संयोजकता निर्धारित करते हैं। उदाहरणार्थ-सिलिकॉन का परमाणु क्रमांक 14 है। इसका इलेक्ट्रॉनिक विन्यास 2, 8, 4 होगा। इसमें 4 संयोजी इलेक्ट्रॉन उपस्थित हैं अर्थात् इसकी संयोजकता 4 है।
ऑक्सीजन का परमाणु क्रमांक 8 है। इसका इलेक्ट्रॉनिक विन्यास 2, 6 होगा। इसमें 6 संयोजी इलेक्ट्रॉन उपस्थित हैं। ऑक्सीजन परमाणु की प्रवृत्ति दो इलेक्ट्रॉन ग्रहण करके अष्टक प्रदान करने की होती है। अतः इसकी संयोजकता 2 है।
प्रश्न 14. Na+, K+, Al3+, 02- और F– में कौन-से समइलेक्ट्रॉनी हैं?
उत्तर-समइलेक्ट्रॉनी स्पीशीज में इलेक्ट्रॉन की संख्या समान होती है।
| आयनी स्पीशीज | तत्त्व की परमाणु सख्या | आयन की परमाणु संख्या | इलेक्ट्रॉन की संख्या |
| Na+ | 11 | 10 | 10 |
| K+ | 19 | 18 | 18 |
| Al3+ | 13 | 10 | 16 |
| 02- | 8 | 10 | 10 |
| F– | 9 | 10 | 10 |
उपर्युक्त सारणी से स्पष्ट है कि Na+, Al3+, 02– और F– में 10-10 इलेक्ट्रॉन हैं। अतः ये समइलेक्ट्रॉनी हैं।
प्रश्न 15. रदरफोर्ड का परमाणु मॉडल क्या है?
उत्तर- रदरफोर्ड का परमाणु मॉडल रदरफोर्ड ने अपने -कणों के प्रकीर्णन के प्रयोग द्वारा प्राप्त निष्कर्षों के आधार पर परमाणु का एक मॉडल प्रस्तुत किया जो निम्न प्रकार है-
(1) परमाणु का अधिकांश द्रव्यमान इसके केन्द्र में निहित है अतः
परमाणु के केन्द्रीय भाग में पोटॉन एवं न्यूट्रॉन विद्यमान है। चे कण न्यूक्लिन कहते है। परमाणु के इस मुक्ष्म केन्द्र को नाभिक या केंन्द्रक कहते हैं।
(2) केन्द्रक के चारों और का अधिकांश भाग रिक्त होता है।
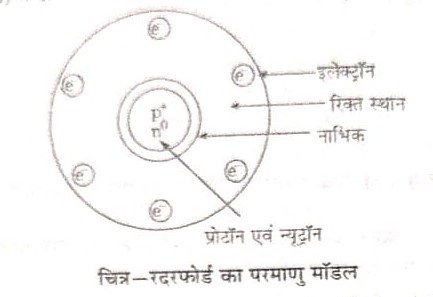
(3) परमाणु के केन्द्रक के चारों ओर इलेक्ट्रॉन गतिशील होते हैं। (4) नाभिक का आकार परमाणु के आकार की तुलना में बहुत छोटा होता है।
(5) चूँकि परमाणु उदासीन होता है अतः परमाणु में उपस्थित प्रोटॉन एवं इलेक्ट्रॉन की संख्या बराबर होती है।
प्रश्न 16. रदरफोर्ड के परमाणु मॉडल के महत्त्वपूर्ण दोषों को व्याख्या कीजिए।
उत्तर- रदरफोर्ड के परमाणु मॉडल के महत्त्वपूर्ण दोष निम्नलिखित हैं-
(1) परमाणु के स्थायित्व की व्याख्या न कर पाना– रदरफोर्ड के परमाणु मॉडल का पहला दोष यह है कि यह परमाणु के स्थायित्व की व्याख्या नहीं करता है। मैक्सवैल के अनुसार, कोई भी आवेशित कण गतिमान होने पर निरन्तर विद्युत चुम्बकीय तरंगों को विकरित करेगा, जिससे उसकी ऊर्जा में लगातार कमी होते रहने से उसे अपनी राह (कक्षा) घटानी पड़ेगी और ऐसा करते हुए अन्त में इलेक्ट्रॉन नाभिक में गिरकर नष्ट हो जायेगा। परन्तु वास्तव में ऐसा घटित नहीं होता।
(2) परमाणु में विविक्त स्पेक्ट्रम की व्याख्या न कर पाना– रदरफोर्ड के परमाणु मॉडल का दूसरा प्रमुख दोष यह है कि यह परमाणु के विविक्त स्पेक्ट्रम की व्याख्या भी नहीं कर पाता। रदरफोर्ड के अनुसार इलेक्ट्रॉन की कक्षा की त्रिज्या निरन्तर बदलती रहने के कारण सतत स्पेक्ट्रम बनना चाहिए परन्तु रैखिक स्पेक्ट्रम प्राप्त होता है।
प्रश्न 17. परमाणु के अवयवी मूल कणों के नाम तथा आवेश लिखिए। ये कण परमाणु के किस भाग में पाये जाते हैं ?
उत्तर- परमाणु में तीन प्रकार के मूल कण (i) इलेक्ट्रॉन (ii) प्रोटॉन (iii) न्यूट्रॉन पाये जाते हैं।
इलेक्ट्रॉन का आवेश 1.6 × 10-19 C; प्रोटॉन का आवेश = + 1.6 × 10-19 °C, न्यूट्रॉन का आवेश = 0, प्रोटॉन तथा नाभिक परमाणु के नाभिक में पाये जाते हैं तथा इलेक्ट्रॉन नाभिक के बाहर चक्कर लगाते हैं।
प्रश्न 18. प्रोटॉन, इलेक्ट्रॉन तथा न्यूट्रॉन में न्यूनतम तथा अधिकतम द्रव्यमान किन कणों का है? प्रोटॉन तथा न्यूट्रॉन के द्रव्यमान, इलेक्ट्रॉन के द्रव्यमान के सापेक्ष लिखिए।
उत्तर- न्यूनतम द्रव्यमान= इलेक्ट्रॉन
अधिकतम द्रव्यमान= न्यूट्रॉन
प्रोटॉन का द्रव्यमान = 2000 इलेक्ट्रॉन का द्रव्यमान (लगभग)।
न्यूट्रॉन का द्रव्यमान = 2000 × इलेक्ट्रॉन का द्रव्यमान (अधिक)।
प्रश्न 19. परमाणु के टॉमसने मॉडल तथा रदरफोर्ड मॉडल में मुख्य अन्तर बताइए।
उत्तर-टॉमसन मॉडल के अनुसार, परमाणु का धनावेश तथा द्रव्यमान एक गोलाकार आकृति में फैला रहता है तथा इलेक्ट्रॉन उसमें जहाँ तहाँ स्थित रहते हैं. परन्तु रदरफोर्ड मॉडल के अनुसार, परमाणु का धनावे शाहाँ स्थित समस्त द्रव्यमान परमाणु के केन्द्र में एक अत्यन्त सूक्ष्म भाग (नाधिक) में केन्द्रित रहता है तथा इलेक्ट्रॉन नाभिक के बाहर काफी दूरी पर चक्कर लगाते रहते हैं।
प्रश्न 20. स्पष्ट कीजिए कि रदरफोर्ड के प्रयोग में अधिकांश अल्फा-कण बिना विचलित हुए स्वर्ण-पत्र के आर-पार क्यों निकल जाते हैं?
उत्तर-परमाणु के अवयवी कणों (नाभिक तथा इलेक्ट्रॉनों) का आकार पूरे परमाणु के आकार का लगभग 10 गुना होता है- अर्थात् परमाणु का अधिकांश भाग रिक्त होता है। अतः अधिकांश अल्फा-कण परमाणु के किसी भी भाग से टक्कर हुए बिना, आर-पार निकल जाते हैं।
प्रश्न 21. दो ऐसे बिन्दु लिखिए जो रदरफोर्ड मॉडल तथा बोर मॉडल में अन्तर स्पष्ट करते हों।
उत्तर-(i) रदरफोर्ड मॉडल में नाभिक के चारों ओर इलेक्ट्रॉन का घूर्णन किसी भी त्रिज्या की कक्षा में हो सकता है, जबकि बोर मॉडल के अनुसार, इलेक्ट्रॉन कुछ विशेष कक्षाओं में ही घूर्णन कर सकता है।
(ii) रदरफोर्ड मॉडल के अनुसार, घूर्णन करता हुआ इलेक्ट्रॉन, त्वरित होने के कारण, विकिरण ऊर्जा का निरन्तर उत्सर्जन करता है-जबकि बोर मॉडल के अनुसार, विशेष त्रिज्याओं की स्थायी कक्षाओं में घूर्णन करते समय ऊर्जा- उत्सर्जन नहीं होता।
प्रश्न 22. बोर मॉडल में ‘स्थिर कक्षा’ से क्या तात्पर्य है? इसे स्पष्ट करते हुए मुख्य क्वाण्टम संख्या का अर्थ समझाइए।
उत्तर-परमाणु में नाभिक के चारों ओर इलेक्ट्रॉन केवल ऐसी विशेष कक्षाओं में घूर्णन कर सकता है, जिनमें इलेक्ट्रॉन का कोणीय संवेग एक नियतांक राशि h/2π का पूर्ण गुणित ही हो। ऐसी कक्षाओं को स्थिर कक्षाएँ कहते हैं।
मुख्य क्वाण्टम संख्या– स्थायी कक्षाओं में इलेक्ट्रॉन का कोणीय संवेग h/2π का पूर्ण गुणित ही हो सकता है-
अर्थात् कोणीय संवेग = n. {h/2π}
जबकि के संभव मान 1,2,3,4,… ही हो सकते हैं। किसी इलेक्ट्रॉन कक्षा के लिए के मान को उस कक्षा की मुख्य क्वाण्टम संख्या कहते हैं।
प्रश्न 23. किसी तत्त्व के ‘परमाणु क्रमांक’ तथा ‘द्रव्यमान संख्या’ की परिभाषाएँ लिखिए। इनसे परमाणु की संरचना के बारे में क्या जानकारी मिलती है?
उत्तर-परमाणु क्रमांक- परमाणु के नाभिक में उपस्थित प्रोटॉनों की संख्या को उसका परमाणु-क्रमांक कहते हैं।
द्रव्यमान संख्या- परमाणु के नाभिक में उपस्थित प्रोटॉनों तथा न्यूट्रॉनों की संपूर्ण संख्या को उसकी द्रव्यमान संख्या कहते हैं।
परमाणु क्रमांक से नाभिक में प्रोटॉनों की संख्या, नाभिक का धनावेश तथा सामान्य दशा में, नाभिक के चारों ओर उपस्थित इलेक्ट्रॉनों की संख्या का शान होता है। यह तीनों राशियाँ समान होती हैं।
द्रव्यमान संख्या से नाभिक में उपस्थित अवयवी कणों (न्यूक्लिऑनों) की सम्पूर्ण संख्या का ज्ञान होता है तथा यह संख्या परमाणु के द्रव्यमान को निकटतम पूर्णांकों में व्यक्त करती है। अतः यह राशि परमाणुओं के अथवा तत्त्वों के सापेक्ष द्रव्यमान को व्यक्त करती है।
प्रश्न 24. बोर का परमाणु मॉडल समझाइये।
उत्तर- बोर का परमाणु मॉडल – नील्स बोर ने क्वाण्टम सिद्धान्त के आधार पर परमाणु संरचना का सरल मॉडल प्रस्तुत किया। इस मॉडल की प्रमुख अभिधारणाएँ निम्नलिखित हैं-
(1) परमाणु के केन्द्र में नाभिक होता है, जिसमें धनावेशित कण (प्रोटॉन) उपस्थित होता है।
(2) इलेक्ट्रॉन नाभिक के चारों ओर निश्चित ऊर्जा वाले पथ में घूमते हैं। ये निश्चित ऊर्जा वाले पथ कक्षा, कोश या ऊर्जा-स्तर कहलाते हैं।
(3) कक्षाओं के क्रम को (n) द्वारा व्यक्त किया जाता है जहाँ n = 1, 2, 3, 4… है जो क्रमश: K, L, M, N… आदि से व्यक्त किये जा सकते हैं।
(4) n के वढ़ते मान के साथ ये कक्षाएँ नाभिक से दूर होती जाती हैं और उनकी ऊर्जा क्रमशः बढ़ती जाती है। कक्षा 2 की ऊर्जा सवसे कम होती है तथा यह नाभिक के निकटतम होती है।
(5) वोर के अनुसार यदि कोई इलेक्ट्रॉन एक ही ऊर्जा स्तर या कक्षा में घूमता रहे तो इस इलेक्ट्रॉन की ऊर्जा में कोई परिवर्तन नहीं होता है।
(6) इलेक्ट्रॉन जब बाहर से ऊर्जा ग्रहण करता है तो उत्तेजित होकर निकटतम उच्च ऊर्जा स्तर में चला जाता है और जब ये ऊर्जा का उत्सर्जन करता है तव निकटतम निम्न ऊर्जा के स्तर में चला जाता है।