UP Board and NCERT Solution of Class 10 Science [विज्ञान] ईकाई 1 रासायनिक पदार्थ- प्रकृति एवं व्यवहार – Chapter- 3 Metals and Non-Metals ( धातु और अधातु ) दीर्घ उत्तरीय प्रश्न
प्रिय पाठक! इस पोस्ट के माध्यम से हम आपको कक्षा 10वीं विज्ञान ईकाई 1 रासायनिक पदार्थ- प्रकृति एवं व्यवहार (Chemical substances- Nature and Behavior ) के अंतर्गत चैप्टर 3 Metals and Non-Metals ( धातु और अधातु ) पाठ के दीर्घ उत्तरीय प्रश्न प्रदान कर रहे हैं। UP Board आधारित प्रश्न हैं। आशा करते हैं हमारी मेहनत की क़द्र करते हुए इसे अपने मित्रों में शेयर जरुर करेंगे।

धातु, अधातु, धातुओं की प्राप्ति, धातुकर्म, धातुओं का संक्षारण, मिश्र धातु
| Class | 10th | Subject | Science (Vigyan) |
| Pattern | NCERT | Chapter- | Metals and Non Metals |
दीर्घ लघु उत्तरीय प्रश्न
प्रश्न 1. फफोलेदार (ब्लिस्टर) कॉपर से शुद्ध कॉपर धातु प्राप्त करने की विद्युत-अपघटनी विधि का सचित्र वर्णन कीजिए।
अथवा ताँबे के शोधन में प्रयुक्त विद्युत अपघटनी विधि का सचित्र वर्णन कीजिए।
उत्तर- ब्लिस्टर कॉपर-वह कॉपर जो 98% शुद्ध होता है और उसमें 2% लोहा, निकिल, कोबाल्ट, लेड, सल्फर, जिंक आदि अशुद्धियां उपस्थित होती हैं, ब्लिस्टर कॉपर कहलाता है।
ब्लिस्टर कॉपर का शोधन (विद्युत अपघटनी विधि)- यह ब्लिस्टर कॉपर शोधन की आधुनिक विधि है। इस विधि में कॉपर सल्फेट (CuSO4) )) का अम्लीय विलयन विद्युत-अपघट्य के रूप में प्रयोग किया जाता है। इसमें अशुद्ध कॉपर की मोटी प्लेट ऐनोड तथा शुद्ध कॉपर की पतली प्लेट कैथोड का कार्य करती हैं।

कैथोड पर : Cu2+ + 2e–→ Cu
ऐनोड पर : SO2-4 + Cu →CuSO4 +2e–
विलयन में विद्युत धारा प्रवाहित करने पर शुद्ध कॉपर कैथोड पर एकत्रित हो जाता है। अधिक विद्युत-धनी अशुद्धियाँ Fe, Co आदि सल्फेट के रूप में घुलकर विलयन में आ जाती हैं परन्तु कम विद्युत-धनी (कम सक्रिय धातुएँ) अशुद्धियों, जैसे-Cu, Au आदि ऐनोड के नीचे एकत्रित हो जाती हैं। इन्हें ऐनोड कीचड़ कहते हैं। इस प्रकार प्राप्त कॉपर 99.99% शुद्ध होता है।
प्रश्न 2. रासायनिक दृष्टि से धातु तथा अधातु में मुख्य अन्तर क्या है?
उत्तर- रासायनिक गुणों के आधार पर
धातु तथा अधातु में अन्तर
|
धातु (Metal) |
अधातु (Non-metal) |
| 1. अधिकांश धातु तनु अम्लों से क्रिया करके हाइड्रोजन गैस मुक्त करती हैं.
जैसे Zn + H₂SO₄ → ZnSO4 + H2↑ |
1. अधातु तनु अम्लों से क्रिया करके हाइड्रोजन गैस विस्थापित नहीं करती हैं। |
| 2. अधिकांश धातु क्षारकीय ऑक्साइड बनाती हैं तथा जल से क्रिया करके क्षार बनाती हैं, जैसे- Na₂O + H₂O → 2NaOH (क्षार) | 2. अधातु अम्लीय ऑक्साइड बनाती हैं और जल में विलेय होकर अम्ल बनाती हैं, जैसे- CO₂+H₂O → H2 CO3 (कार्बोलिक अम्ल) |
| 3. धातु क्लोरीन से क्रिया. करके आयनिक या वैद्युत संयोजक यौगिक बनाती हैं जो विद्युत- अपघट्य, परन्तु अवाष्पशील होते हैं। जैसे-
(i) 2Na + Cl2 → 2NaCl (ii) Mg +Cl2 → MgCl2 |
3. अधातु क्लोरीन से क्रिया करके सहसंयोजक यौगिक बनाती हैं जो विद्युत-अनपघट्य, परन्तु वाष्पशील होते हैं। जैसे-
(i) 2As+3C2→2AsCl3 (ii) 2P+5Cl2→2PCl5 |
| 4. धातु अपचायक होती हैं; जैसे
2Na + BeCl2 → Be + 2NaCl |
4. अधातु ऑक्सीकारक होती हैं, (कार्बन अपवाद है) जैसे- Cl₂+H₂S→ 2HCl + S |
| 5. धातु ऑक्सीजन से क्रिया करके क्षारीय ऑक्साइड बनाती हैं, जैसे-
4Na + O₂ → 2Na₂O |
5. अधातु अम्लीय अथवा उदासीन ऑक्साइड बनाती हैं, जैसे-C+O₂→ CO₂ |
प्रश्न 3. लोहे पर जंग क्यों लगता है? इसे जंग से बचाने के लिए दो उपाय लिखिए।
अथवा संक्षारण पर टिप्पणी लिखिए।
अथवा संक्षारण क्या होता है? इसके निवारण की दो विधियाँ लिखिए।
उत्तर- संक्षारण (Corrosion)- अनेक धातुओं की सतहें वायु तथा जल से प्रभावित होती हैं। आयरन को जब आर्द्र वायु में अधिक समय तक खुला छोड़ देते हैं तो इसकी सतह पर भूरे रंग का एक पपड़ीदार पदार्थ का आवरण उत्पन्न हो जाता है इसे जंग कहते हैं। जंग हाइड्रेटेड आयरन (III) ऑक्साइड (Fe,OxHO) होता है। इसी प्रकार, कॉपर को आर्द्र वायु में खुला छोड़ देने पर उसकी सतह पर हरे रंग के बेसिक कॉपर कार्बोनेट का आवरण उत्पन्न हो जाता है। अतः जब धातु सतह, जल, वायु या अन्य किसी पदार्थ से प्रभावित होती है तो इसे धातु का संक्षारित (corrode) होना कहते हैं। इस परिघटना को संक्षारण कहते हैं।
कभी-कभी धातुओं का संक्षारण लाभदायक होता है, क्योंकि इस आवरण के नीचे स्थित धातुओं की और अधिक हानि नहीं हो सकती है। दूसरे शब्दों में, संक्षारण धातुओं के रक्षक का कार्य करता है। ऐलुमिनियम को वायु में खुला छोड़ देने पर उसकी सतह पर ऐलुमिनियम ऑक्साइड की एक पतली परत का आवरण उत्पन्न हो जाता है। यह रक्षक परत अपने नीचे स्थित धातु को और अधिक क्षति होने से रोकती है। अतः ऐलुमिनियम धातु से बनी वस्तुएँ संक्षारित नहीं होती हैं। आयरन के संक्षारण के कारण उससे बनी वस्तुएँ धीरे-धीरे जंग लगने के कारण खराब होती जाती हैं। संक्षारण को रोकने के लिए तैलीकरण, पेण्ट करना, ग्रीसीकरण, यशद लेपन (आयरन की वस्तुओं पर जिंक का आवरण चढ़ाना), क्रोम- लेपन आदि किया जाता है। ऐसा करने से लोहे के जंग लगने के प्रक्रम को रोका जा सकता है।
प्रश्न 4. कॉपर पाइराइट से फफोलेदार ताँबा प्राप्त करने की विधि का वर्णन कीजिए। सम्बन्धित अभिक्रियाओं के समीकरण लिखिए।
उत्तर- बेसेमरीकरण- प्रगलन क्रिया से प्राप्त द्रवित मैट (Cu2S तथा FeS का मिश्रण) में थोड़ा गालक सिलिका (क्वार्ज SiO₂) मिलाकर एक बेसेमर परिवर्तक में भर देते हैं। बेसेमर परिवर्तक नाशपाती के आकार का इस्पात का बना बर्तन होता है जिसके ऊपरी सतह से अग्निसह ईंटों तथा मैग्नीशिया (MgO) का अस्तर लगा होता है। परिवर्तक के मध्य में ट्वीयर (Tuyeres) लगे होते हैं जिसके द्वारा परिवर्तक में वायु की तेज धारा प्रवाहित की जाती है। परिवर्तक एक स्टैण्ड पर लगा रहता है, इसे स्टैण्ड पर ऊपर नीचे घुमाया जा सकता है।

द्रवित मैट और सिलिका के मिश्रण में वायु की तेज धारा प्रवाहित करने पर निम्न क्रिया होती है
(a) मैट में उपस्थित फेरस सल्फाइड ऑक्सीकृत होकर फेरस ऑक्साइड बनाता है जो सिलिका या रेत से क्रिया करके धातुमल फेरस सिलिकेट (FeSiO3) में बदल जाता है, इसे अलग कर लिया जाता है।
(i) 2FeS +302→ 2FeO +2SO2↑
(ii) FeO+SiO2→ FeSiO3
(b) क्यूप्रस सल्फाइड भी आंशिक रूप से क्यूप्प्रस ऑक्साइड में ऑक्सीकृत हो जाता है जो शेष क्यूप्रस सल्फाइड (Cu₂S) से क्रिया करके कॉपर में बदल जाता है।
2Cu2S+302 → 2Cu2O + 2SO2↑
Cu2S+2Cu2O → 6Cu+ SO2 ↑
इस प्रकार प्राप्त पिघले हुए गर्म कॉपर को सिलिका की बनी टंकी में पलट देते हैं। जैसे-जैसे यह पिघला हुआ कॉपर ठण्डा होता है उसमें से घुली हुई SO2 गैस बुलबुले (Bubbles) के रूप में बाहर निकलने लगती है जिससे कॉपर धातु की सतह पर फफोले पड़ जाते हैं। इस प्रकार प्राप्त कॉपर को फफोलेदार कॉपर (Blister Copper) कहते हैं। यह 98% शुद्ध होता है। इसमें 2% लोहा (Fe), निकल (Ni), कोबाल्ट (Co), लेड (Pb), सल्फर (S) आदि अशुद्धियों के रूप में उपस्थित होते हैं।
प्रश्न 5. अयस्क सान्द्रण के फेन प्लवन विधि का सिद्धान्त एवं विधि का विवरण लिखिए।
उत्तर- अयस्क सान्द्रण की फेन प्लवन विधि का सिद्धान्त– यह विधि सल्फाइडों के सान्द्रण के लिए प्रयुक्त होती है। यह विधि इस सिद्धान्त पर आधारित है कि धात्विक सल्फाइड तेल द्वारा अपेक्षाकृत तेजी से आर्द्र (Wet) हो जाते हैं जबकि सिलिकेट अपद्रव्य जल द्वारा तेजी से आर्द्र होते हैं। जल-तेज मिश्रण में बने सल्फाइड अयस्क के निलम्बन (Suspension) में चायु धोंकने से तैलीय झाग बनता है जो धात्विक सल्फाइड अयस्क के कणों को अपने साथ तल पर ले आता है और मिट्टी, कंकड़, पत्थर आदि गैंग अपद्रव्य नीचे तली में चले जाते हैं। इस विधि द्वारा 1% अयस्क को 95% तक सान्द्रित किया जा सकता है।
फेन-प्लवन विधि में प्रायः दो प्रकार के पदार्थ काम में आते हैं一
(a) फेन कारक (Frothing Agents) और
(b) प्लवन कारक (Floatation Agents) |
(a) फेन कारक (Frothing Agents)- ये पदार्थ वायु-बुलबुलों के स्थायी फेन बनाने में सहायक होते हैं। चीड़ का तेल (Pine oil) और नीलगिरी तेल (Eucalyptus oil) अच्छे फेन कारक हैं।
(b) प्लवन कारक (Floatation Agents)- ये पदार्थ सल्फाइड अयस्क के कणों को जल प्रत्यकर्षी (Water repellent) बना देते हैं ताकि वे जल पर तैर सकें।
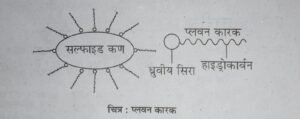
प्लवन कारक दो भागों से मिलकर बने होते हैं-
- ध्रुवीय सिरा (Polar head) और
- हाइड्रोकार्बन पुच्छ (Hydrocarbon tail)।
इनके ध्रुवीय सिरे सल्फाइड अयस्क के कणों से चिपक जाते हैं तथा हाइड्रोकार्बन पुच्छ बाहर को फैल जाती है। इसके फलस्व-रूप सल्फाइड कण तेल की बूँदों की भाँति व्यवहार करते हैं। अतः वायु के बुलबुलों द्वारा वे तल पर पहुँचते हैं और तैलीय झाग से जा मिलते हैं। प्लवन कारकों में सोडियम एथिल जैन्थेट या सोडियम ऐमिल जैन्थेट प्रमुख हैं। इन्हें सूत्र
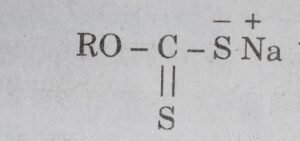
द्वारा व्यक्त कर सकते हैं। यहाँ R-एथिल या S
ऐमिल समूह है। इन यौगिकों की अतिसूक्ष्म मात्रा (अयस्क के द्रव्यमान के लगभग 0.1%) ही काफी होती है।
फेन-प्लवन विधि का विवरण– पानी के एक बड़े आयताकार बर्तन में अयस्क को बारीक पीसकर डाल दिया जाता है। इसमें तारपीन, चीड़ या नीलगिरी का तेल मिला

देते हैं। साथ ही अल्प मात्रा में प्लवन कारक पदार्थ मिलाते हैं और फिर हवा की प्रबल धारा भेजते हैं। शुद्ध सल्फाइड अयस्क झाग के साथ ऊपर तैरने लगता है। इसे वहाँ से अलग कर लेते हैं। मिट्टी, कंकड़, पत्थर आदि अपद्रव्य नीचे बैठ जाते हैं।
प्रश्न 6. दो अयस्क A तथा B लिए गए। अयस्क A, गरम करने पर CO2 देता है। जबकि B गरम करने पर SO2 देता है। इनको धातुओं में परिवर्तित करने के लिए आप कौन-से पद काम में लेंगे?
उत्तर- चूंकि अयस्क ‘A’ CO2 देता है इसलिए यह MCO3 है।
अयस्क ‘B’ SO2 देता है इसलिए यह MS है।
A को प्राप्त करने की विधि-
(i) निस्तापन, (ii) कार्बन द्वारा अपचयन

प्रश्न 7. कारण बताइए, ऐसा क्यों है कि-
(i) सोडियम अथवा ऐलुमिनियम के ऑक्साइडों के अपचयन के लिए कार्बन का उपयोग नहीं किया जाता है।
(ii) कॉपर सल्फेट के नीले विलयन में आयरन की पत्ती डुबाने पर नीला विलयन फीका हरा हो जाता है।
(iii) धातुएँ अम्लों से हाइड्रोजन विस्थापित कर देती हैं जबकि अधातुएँ ऐसा नहीं करतीं।
(iv) आयरन के गैल्वनीकरण में जिंक का उपयोग किया जाता है, कॉपर का नहीं।
उत्तर- (i) क्योंकि Na अथवा Al कार्बन की तुलना में अधिक सक्रिय धातु हैं, जिन्हें कार्बन अपचयित नहीं कर सकता है।
(ii) क्योंकि आयरन, Cu से अधिक क्रियाशील है, जिसके कारण विस्थापन अभिक्रिया होती है तथा नीला रंग हल्का हरा हो जाता है, जो FeSO4 के बनने के कारण होता है।
(iii) क्योंकि अधातुएँ इलेक्ट्रॉन का त्याग कर हाइड्रोजन आयनों को (जओ अम्ल में होते हैं) नहीं दे पानी हैं, जिसके कारण H2 गैस नहीं निकलती है अर्थात् हाइड्रोजन विस्थापित नहीं हो पाता है।
(iv) क्योंकि जिंक की परत चढ़ाने पर आयरन का संक्षारण नहीं होता है। जिंक की परत नष्ट हो जाने के बाद भी यशदलेपित (गैल्वनीकृत) वस्तु जंग से सुरक्षित रहती है।