UP Board and NCERT Solution of Class 9 Science [विज्ञान] ईकाई 1 द्रव्य- प्रकृति एवं व्यवहार – Chapter-3 Atoms and Molecules ( परमाणु एवं अणु ) दीर्घ उत्तरीय प्रश्न Dirgh Uttareey Prashn
प्रिय पाठक! इस पोस्ट के माध्यम से हम आपको कक्षा 9वीं विज्ञान ईकाई 1 द्रव्य- प्रकृति एवं व्यवहार के अंतर्गत चैप्टर3 (परमाणु एवं अणु) पाठ के दीर्घ उत्तरीय प्रश्न प्रदान कर रहे हैं। UP Board आधारित प्रश्न हैं। आशा करते हैं कि पोस्ट आपको पसंद आयेगी अगर पोस्ट आपको पसंद आई तो इसे अपने दोस्तों के साथ में जरुर शेयर करें

| Class | 9th | Subject | Science (Vigyan) |
| Pattern | NCERT | Chapter- | Atoms and Molecules |
दीर्घ उत्तरीय प्रश्न / Dirgh Uttareey Prashn
प्रश्न 1. स्थिर अनुपात का नियम क्या है ? उदाहरण सहित समझायें।
उत्तर-स्थिर अनुपात का नियम-प्राउस्ट (Proust 1779) के अनुसार, “किसी यौगिक में दो या अधिक तत्त्व एक निश्चित अनुपात में संयोजन करते हैं।” अथवा
“किसी रासायनिक यौगिक में तत्त्व हमेशा द्रव्यमानों के निश्चित अनुपात में विद्यमान होते हैं।”
उदाहरण के लिए अगर हम जल किसी भी स्रोत नदी, तालाब, झरना आदि से लें। शुद्ध जल में 1 g हाइड्रोजन सदैव 8 g ऑक्सीजन से संयोग करती है या हम कह सकते हैं कि हाइड्रोजन व ऑक्सीजन के द्रव्यमानों में 1:8 का अनुपात होता है। इसी प्रकार, कार्बन डाइऑक्साइड हम किसी भी तरह उत्पादित करें जैसेः
(i) किसी ईंधन या कोयले के दहन से
(ii) चूना पत्थर को गर्म करके
(iii) संगमरमर पर तनु अम्ल की अभिक्रिया से
(iv) श्वसन द्वारा।
कार्बन डाइऑक्साइड में कार्बन और ऑक्सीजन के द्रव्यमानों में 3:8 का अनुपात होगा।
प्रश्न 2. डाल्टन के परमाणु सिद्धान्त की संकल्पनाएँ लिखिए तथा इसकी कमियाँ बताइए।
उत्तर- डाल्टन का परमाणु सिद्धान्त-डाल्टन के परमाणु-सिद्धान्त के अनुसार,
(i) सभी पदार्थ अनेक सूक्ष्म कणों के बने हैं, जिन्हें परमाणु कहते हैं। (ii) परमाणु तत्त्व का सूक्ष्मतम कण है जिसे विभाजित नहीं किया जा सकता है और रासायनिक अभिक्रिया के दौरान ज्यों का त्यों बना रहता है।
(iii) परमाणुओं को न तो बनाया जा सकता है और न ही नष्ट किया जा सकता है।
(iv) परमाणु अनेक प्रकार के होते हैं। जितने प्रकार के तत्त्व हैं, उतने ही प्रकार के परमाणु हैं।
(v) एक ही तत्त्व के सभी परमाणु आकार, द्रव्यमान तथा रासायनिक गुणों में एक-दूसरे के समान होते हैं और इनका द्रव्यमान निश्चित होता है।
(vi) विभिन्न तत्त्वों के परमाणु आकार, द्रव्यमान तथा अन्य सभी गुणों में एक-दूसरे से भिन्न होते हैं।
(vii) दो या दो से अधिक तत्त्वों के परमाणु सरल गुणित अनुपात में संयुक्त होकर यौगिक परमाणु बनाते हैं।
डाल्टन के परमाणु सिद्धान्त की कमियाँ– आधुनिक खोजों से ज्ञात हुआ है कि द्रव्य (पदार्थ) सम्बन्धी डाल्टन के परमाणु-सिद्धान्त के कुछ कथन पूर्णतया सही नहीं हैं। डाल्टन के परमाणु सिद्धान्त की कुछ कमियाँ निम्नलिखित हैं-
(i) डाल्टन के परमाणु सिद्धान्त की प्रमुख कमी यह है कि परमाणु को अविभाज्य (जो विभाजित नहीं किया जा सकता) माना गया था। आधुनिक खोजों से ज्ञात हो चुका है कि परमाणु अविभाज्य नहीं है। उसे विशिष्ट परिस्थितियों में, सूक्ष्मतम कणों-इलेक्ट्रॉन, प्रोटॉन तथा न्यूट्रॉन में विभाजित किया जा सकता है।
(ii) यह सिद्धान्त इस बात को समझाने में असफल रहा कि एक ही प्रकार के परमाणुओं से बने कुछ पदार्थ गुणधर्मों में भिन्न क्यों होते है? उदाहरणार्थ-चारकोल, हीरा तथा ग्रेफाइट सभी पदार्थ एक ही प्रकार के कार्बन परमाणुओं से बने होने पर भी गुणधर्मों में क्यों भिन्न होते हैं। इसे डाल्टन का परमाणु सिद्धान्त न समझा सका।
(iii) डाल्टन के परमाणु सिद्धान्त के अनुसार, किसी एक तत्त्व के सभी परमाणुओं का द्रव्यमान समान होता है। आज ज्ञात किया जा चुका है कि एक ही तत्त्व के परमाणुओं का द्रव्यमान भिन्न-भिन्न भी हो सकता है।
(iv) डाल्टन ने अपने द्रव्य के परमाणु सिद्धान्त में बताया कि विभिन्न तत्त्वों के परमाणुओं के द्रव्यमान भिन्न-भिन्न होते हैं। आज ज्ञात हो चुका है कि भिन्न-भिन्न तत्त्वों के परमाणुओं के द्रव्यमान समान भी हो सकते हैं।
(v) डाल्टन के परमाणु सिद्धान्त के अनुसार, परमाणु को न तो नष्ट किया जा सकता है और न बनाया ही जा सकता है। आज परमाणुओं को बनाया भी जा सकता है और नष्ट भी किया जा सकता है। उदाहरणार्थ- एक तत्त्व के परमाणु को दूसरे तत्त्व के परमाणु में परिवर्तित किया जा सकता है।
(vi) डाल्टन के परमाणु-सिद्धान्त में बताया गया कि परमाणु सदैव सरल पूर्णांक अनुपात में संयोग करके यौगिक बनाते हैं। आज यह सही नहीं है। अनेक कार्बनिक यौगिकों में तत्त्वों के परमाणुओं का अनुपात पूर्ण सांख्यिक तो होता है, परन्तु यह सरल नहीं होता है।
उदाहरणार्थ, सोडियम क्लोराइड का मोलर द्रव्यमान = 58.5 g
प्रश्न 3. ‘आयन’ से क्या तात्पर्य है? किसी परमाणु से आयन कैसे बनता है ? धनात्मक एवं ऋणात्मक, दोनों प्रकार के आयनों को उदाहरण देकर स्पष्ट कीजिए।
उत्तर-आयन-सामान्यतः सभी परमाणुओं तथा अणुओं में प्रोटॉनों तथा इलेक्ट्रॉनों की संख्याएँ परस्पर बराबर होती हैं, जिससे वे विद्युत-उदासीन होते हैं। विशेष अवस्थाओं में कुछ परमाणु अपने बाह्यतम इलेक्ट्रॉन कोश से कुछ इलेक्ट्रॉनों का त्याग कर देते हैं, अथवा उसमें कुछ अतिरिक्त इलेक्ट्रॉन को ग्रहण कर लेते हैं। ऐसे परमाणु जिनमें प्रोटॉनों तथा इलेक्ट्रॉनों की संख्याएँ समान नहीं होती, आवेशित होते हैं। इन आवेशित परमाणुओं को आयन कहते हैं।
परमाणु या परमाणुओं का ऐसा समूह जिस पर स्वतन्त्र आवेश विद्यमान होता है आयन कहलाता है जैसे-Na+, CI–, NH4+, SO42-, Al3+ आदि। ये दो प्रकार के होते हैं- (i) धनावेशित आयन (ii) ऋणावेशित आयन।
(i) धनावेशित आयन-ऐसा परमाणु या परमाणुओं का समूह जिस पर धनावेश होता है, धनावेशित आयन या क्षारीय मूलक कहलाते हैं। जैसे-NH+4, Mg2+, Cu2+, Fe3+ इत्यादि।
(ii) ऋणावेशित आयन-परमाणु या परमाणुओं का ऐसा समूह जिस पर ऋणावेश होता है, ऋणावेशित आयन या अम्लीय मूलक कहलाते हैं। जैसे- CI–, SO2-4 CO2-3, PO3-4 इत्यादि।
प्रश्न 4. अणु कितने प्रकार के होते हैं? उदाहरण देकर समझाइए।
उत्तर-अणु के प्रकार-अणु निम्न दो प्रकार के होते हैं-
- समपरमाणुक अणु (Homoatomic molecules)-समान प्रकार के परमाणुओं के संयोजन से बने अणु को समपरमाणुक अणु कहते हैं। सरल पदार्थों (तत्त्वों) के अणु समपरमाणुक होते हैं। अणु में उपस्थित परमाणुओं की संख्या अणु की परमाणुकता कहलाती हैं। जिस तत्त्व के अणु में केवल एक परमाणु होता है उसे एकपरमाणुक कहते हैं। उत्कृष्ट गैसों (He, Ne, Ar, Kr आदि) तथा धातुओं के अणु एकपरमाणुक होते है। दो परमाणुओं से बने अणु को द्विपरमाणुक अणु कहते हैं। हाइड्रोजन, नाइट्रोजन, ऑक्सीजन तथा क्लोरीन व अन्य हैलोजन के अणु द्विपरमाणुक होते हैं, जैसे H2, N2, O2, CI2, ओजोन के अणु त्रिपरमाणुक (O3), फॉस्फोरस के अणु चतुष्परमाणुक (P4). तथा सल्फर के अणु अष्टपरमाणुक (S8) होते हैं।
- विषमपरमाणुक अणु (Heteroatomic molecules)-पित्र प्रकार के दो या दो से अधिक परमाणुओं से बने अणु को विषमपरमाणुक अणु कहते हैं।
यौगिकों के अणु विषमपरमाणुक होते हैं। उदाहरणार्थ-H₂O, जल का अणु दो हाइड्रोजन परमाणुओं तथा एक ऑक्सीजन परमाणु से बना होता है। NH3 अमोनिया का अणु एक नाइट्रोजन परमाणु तथा तीन हाइड्रोजन परमाणुओं से बना होता है।
प्रश्न 5. तत्त्व के ‘प्रतीक’ से क्या तात्पर्य है? उदाहरण देकर समझाइए कि दो तत्त्वों के प्रतीकों एवं संयोजकता के ज्ञान से, उनसे बनने वाले यौगिक का अणुसूत्र कैसे ज्ञात करेंगे?
उत्तर- तत्त्व का प्रतीक किसी तत्त्व का संक्षिप्त नाम उसका प्रतीक कहलाता है। कुछ तत्त्वों के प्रतीक उनके अंग्रेजी नाम के पहले अक्षर हैं। जैसे- कार्बन का C, ऑक्सीजन का है। जब एक से अधिक प्रतीक एक ही अक्षर से आरम्भ होते हैं तो उनके प्रतीक को दो अक्षरों से लिखते हैं। एक अक्षर तत्त्व के नाम का पहला अक्षर और एक अन्य अक्षर ले लेते हैं। इसमें पहला अक्षर बड़ा और दूसरा अक्षर छोटा लिखते हैं। जैसे कार्बन का प्रतीक C, कोबाल्ट का Co और कैल्सियम का Ca है। कुछ त्तत्त्वों के प्रतीक उनके लैटिन नाम के आधार पर लिखे जाते हैं। जैसे-लोहे का लैटिन नाम Ferrum है और उसका प्रतीक Fe है। ताँबे का लैटिन नाम Cuprum है और इसका प्रतीक Cu है।
किसी तत्त्व का प्रतीक उसके एक परमाणु को व्यक्त करता है। इसके अतिरिक्त तत्त्व का प्रतीक उस तत्त्व के परमाणु द्रव्यमान के बराबर तत्त्व की मात्रा को प्रदर्शित करता है- अर्थात् प्रतीक तत्त्व की उस मात्रा का सूचक है जो तत्त्व के परमाणु द्रव्यमान के बराबर होती है।
अणुसूत्र ज्ञात करना-यदि कोई यौगिक दो तत्त्वों A तथा B के संयोग से बना हुआ है और उन तत्त्वों की संयोजकता ज्ञात है तो यौगिक का सूत्र बनाया जा सकता है।
सर्वप्रथम उन दो तत्त्वों के प्रतीकों को पास-पास लिखते हैं जिनसे यौगिक बना हुआ है।
इसके उपरान्त तत्त्वों की संयोजकता उनके प्रतीकों के ऊपर लिखते हैं। अन्त में तत्त्वों की संयोजकता एक-दूसरे से बदलकर दोनों तत्त्वों के प्रतीकों के दायीं तरफ पादांक के रूप में लिखते हैं।
माना कि तत्त्व A की संयोजकता तथा तत्त्व B की संयोजकता y है। तत्त्व A एवं B के संयोग से बने यौगिक का सूत्र बनाने के लिए
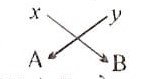
अतः इस यौगिक का सूत्र AyBx होगा
प्रश्न 6. रासायनिक सूत्र से क्या तात्पर्य है? उदाहरण देकर बताइए कि किसी पदार्थ के सूत्र से पदार्थ के बारे में क्या जानकारियां मिलती हैं?
उत्तर-रासायनिक सूत्र- जिस प्रकार तत्त्व को संक्षिप्त रूप में व्यत करने के लिए प्रतीकों का प्रयोग किया जाता है ठीक उसी प्रकार यौगिक को प्रकर करने के लिए ‘प्रतीकों के समूह’ का जिसे सूत्र कहते हैं, प्रयोग किया जाता है। उदाहरण के लिए, जब मैग्नीशियम का एक परमाणु क्लोरीन के दो परमाणुओं से संयोग करता है तो मैग्नीशियम क्लोराइड का एक अणु बनता है। इस प्रकार बने यौगिक को मैग्नीशियम और क्लोरीन के प्रतीकों के समूह अर्थात् MgCl, द्वारा प्रदर्शित कर सकते हैं। यही मैग्नीशियम क्लोराइड का सूत्र कहलाता है, अतः “प्रतीकों का वह समूह जो किसी पदार्थ के अणु को प्रकट करता है, रासायनिक सूत्र कहलाता है।”
किसी तत्त्व या यौगिक के एक अणु को सूत्र द्वारा व्यक्त किया जाता है। सूत्र, एक अणु में उपस्थित तत्त्वों के नामों को तथा उनके परमाणुओं की संख्या को व्यक्त करता है।
उदाहरणतः ऑक्सीजन अणु का सूत्र O₂ तथा ओजोन अणु का सूत्र O3 है – अर्थात् ऑक्सीजन के एक अणु में ऑक्सीजन के दो परमाणु तथा ओजोन के एक अणु में ऑक्सीजन के तीन परमाणु हैं। इसी प्रकार सल्फ्यूरिक एसिड (H₂SO₄) का एक अणु दो हाइड्रोजन, एक सल्फर तथा चार ऑक्सीजन परमाणुओं के संयोग से बना है।
किसी यौगिक के आण्विक या रासायनिक सूत्र से निम्नलिखित बातों का बोध होता है-
- पदार्थ और उसके एक अणु का ज्ञान होता है।
- यौगिक के अवयवी तत्त्वों का ज्ञान होता है।
- यौगिक के अणु में उपस्थित भिन्न-भिन्न तत्त्वों के परमाणुओं की वास्तविक संख्या का ज्ञान होता है।
- यौगिक के एक अणु में भार की दृष्टि से भिन्न-भिन्न तत्त्वों के अनुपात का ज्ञान होता है।
- आण्विक सूत्र, पदार्थ के परमाणु-संघटन को संक्षेप में व्यक्त करता है।
- आण्विक सूत्रों का रासायनिक अभिक्रियाओं को संक्षेप में व्यक्त करने तथा रासायनिक गणनाओं में विशेष महत्त्व है।